Elektron
Elektron
| |
Crookesova cijev: elektroni putuju ravno s lijeve strane gdje je katoda, na desnu stranu gdje je anoda (žica na dnu cijevi desno). Kao dokaz struje elektrona postavljen je Malteški križ koji baca sjenu na desnu stranu cijevi.
| |
| Kompozicija: | Elementarna čestica |
| Čestična statistika: | Fermion |
| Grupa: | Lepton |
| Porodica: | Prva |
| Međudjelovanje: | gravitacijsko, elektromagnetsko, slabo |
| Simbol(i): | e⁻, β⁻ |
| Antičestica: | Pozitron (antielektron) |
| Teoretiziran: | Richard Laming (1838. – 1851.), G. Johnstone Stoney (1874.) i ostali |
| Otkriven: | Joseph John Thomson (1897.) |
| Masa: | 9,109 382 15(4 5)×10−31 kg
5,485 799 094 3(23)×10−4 u |
| Električni naboj: | −1 e |
| Magnetski moment: | −1,001 159 652 181 11 μB |
| Spin: | 1⁄2 |









Elektron je negativno nabijena, stabilna subatomska čestica. Elektron je uz proton i neutron jedna od sastavnih čestica atoma. Pripada fermionima i leptonima, najlakši je od tri otkrivena električki nabijena leptona. Valna duljina λ elektrona zadana je de Broglievom relacijom:
gdje je v nerelativistička brzina elektrona, h Planckova konstanta, me masa elektrona. Najčešće se elektroni oslobađaju iz atoma, molekula ili kristalne rešetke obasjavanjem svjetlošću, izlaganjem rendgenskomu zračenju ili elektronima, zagrijavanjem na visoke temperature i slično. Atomske jezgre izbacuju elektrone u obliku beta-zračenja (radioaktivnost); elektroni nastaju i u nizu procesa među elementarnim česticama. Par elektron-antielektron nastaje iz visokoenergijskoga gama-kvanta (energije iznad 1 MeV).[2]
Svojstva[uredi | uredi kôd]
Opća svojstva[uredi | uredi kôd]
gdje je reducirana Planckova konstanta.
Dualna priroda elektrona[uredi | uredi kôd]
Louis de Broglie je u svojoj doktorskoj disertaciji iz 1924. uveo hipotezu o elektronskim valovima, odnosno pretpostavio da elektronima u pokretu treba pridružiti i valna svojstva. Prije njega, zahvaljujući Einsteinovom objašnjenju fotoelektričnog učinka i Planckovom objašnjenju zračenja apsolutno crnog tijela, ukazala se nužnost da se zrakama svjetlosti (elektromagnetskom zračenju) pridruže i čestična svojstva. De Broglie je stoga postavio obrnuto pitanje: "Ako svjetlost osim valnih posjeduje i čestična svojstva, treba li česticama tvari, kao što su, primjerice, elektroni, osim čestičnih pridružiti i valna svojstva?"
Ovu njegovu pretpostavku o valnim svojstvima čestica znanstvena je javnost u prvi mah primila s nevjericom, pa čak i podsmijehom.[provjeriti] Međutim, njegovu teoriju su potvrdili L. Germer i C. J. Davisson 1927. godine u pokusu kojim je dokazan ogib ili difrakcija elektrona na kristalima. Difrakcijska slika je bila dokaz valne prirode elektrona. Za rad na valnoj mehanici i za otkriće valne prirode elektrona dobio je Nobelovu nagradu za fiziku 1929. Jedna od primjena njegovog otkrića je elektronski mikroskop, koji je imao mnogo veću rezoluciju od optičkih mikroskopa jer je valna duljina elektrona mnogo kraća od valne duljine svjetlosti. De Broglieova hipoteza postala je tako jedan od osnovnih postulata nove valne ili kvantne mehanike, ali također uvela u fiziku i problem takozvanog valno-čestičnog dualizma. Kao primjer ove pojave danas se najčešće navodi pokus ogiba elektrona na dvostrukom prorezu.
Električni naboj[uredi | uredi kôd]
Električni naboj ili količina elektriciteta (oznaka q ili Q) je fizikalna veličina koja opisuje temeljno svojstvo čestica koje uzajamno djeluju električnim silama. Određuje se kao umnožak električne struje I i vremena njezina protjecanja t:
Mjerna jedinica električnoga naboja je kulon (C).
Postoje dvije vrste električnoga naboja, pozitivni i negativni, koji su po svojim učincima suprotni. Čestice ili fizikalna tijela nabijena istoimenim električnim nabojem međusobno djeluju odbojnom silom, a čestice ili tijela nabijena raznoimenim električnim nabojem se privlače. Električki nabijene čestice u mirovanju stvaraju električna polja, a električki nabijene čestice u gibanju stvaraju električna, elektromagnetska i magnetska polja. Dogovorno je označen kao pozitivan onaj električni naboj što ga trenjem dobije stakleni štap, a kao negativan, električni naboj proizveden trenjem na štapu od smole. Atomi su električki neutralni i većina tvari na Zemlji je električki neutralna. Tvari postaju električki nabijene kad se u njima razdvoje različito nabijene čestice, to jest kad se pojedini elektroni izdvoje iz atoma. Nositelji negativnoga električnoga naboja najčešće su elektroni, a nositelji pozitivnoga naboja najčešće su atomi kojima nedostaje jedan ili više elektrona (ion) odnosno, na subatomskoj razini, protoni.
Električni naboji tijela uvijek su višekratnici elementarnog električnog naboja elektrona e = –1,602177 · 10–19 C. Jedine do danas poznate čestice koje mogu imati električni naboj manji od naboja elektrona su kvarkovi.[3] Električni naboj je temeljno očuvano svojstvo nekih subatomskih čestica, koje određuje njihovu elektromagnetsku interakciju. Električki nabijena materija utječe na, i stvara, elektromagnetska polja. Međudjelovanje između naboja i polja je izvor jedne od četiri fundamentalne sile, i to elektromagnetske sile.
Povijest istraživanja[uredi | uredi kôd]
Prvi je Tales iz Mileta (600 pr. Kr.) pisao da jantar (grč. ἤλεϰτρον, ḗlektron), kada se tare, privlači sitne čestice tvari, a W. Gilbert otkrio je da i druge tvari, a ne samo jantar, imaju električno svojstvo. Pojavu električnoga odbijanja prvi je 1672. opazio Otto von Guericke, a 1663. konstruirao je prvi elektrostatički stroj na trenje. Razliku među vodičima i izolatorima otkrio je Stephen Gray. Francuski kemičar C. F. C. du Fay utvrdio je 1734. različitost električnog naboja nastalog trljanjem stakla od naboja nastalog trljanjem smole, a G. Ch. Lichtenberg nazvao je pozitivnim električni naboj nastao trljanjem stakla. Oko 1747. B. Franklin konstatirao je da se pri trenju stvaraju uvijek jednake količine pozitivnog i negativnog električnog naboja. Istraživanjem sila koje djeluju među električnim nabojima bavili su se H. Cavendish i J. Priestley, a zakon o ovisnosti privlačne ili odbojne sile o nabojima i udaljenosti među nabojima, a osnovi pokusa formulirao, Ch. A. de Coulomb, pa se po njemu mjerna jedinica električnog naboja naziva kulon (C). Prema Coulombovu zakonu sila F koja djeluje između dvaju točkastih električnih naboja q1 i q2 razmjerna je produktu obaju naboja, a obrnuto razmjerna kvadratu njihova razmaka r:
gdje je: ε0 - dielektrična permitivnost vakuuma. Sila je najjača u vakuumu, a slabija u svim drugim sredstvima:[4]
gdje je: εr - relativna dielektrična permitivnost nekog sredstva ili tvari, ε - dielektrična permitivnost (ili samo permitivnosti) tvari.
Sila F je vektor, pa je i jakost električnog polja E vektorska veličina, a kao smjer električnoga polja uzima se onaj smjer u kojem djeluju sile na pozitivni naboj. Električno polje može se opisati i skalarnim veličinama, potencijalima V. Električni naboji mogu pod utjecajem električnih sila obavljati mehanički rad, a to znači da u svakoj točki polja električni naboj q ima izvjesnu potencijalnu energiju (električni potencijal) s obzirom na neku referentnu točku u polju kojoj se pripisuje potencijal φ = 0. To je obično vrlo udaljena točka u polju ili Zemlja. Sve točke u polju koje imaju isti potencijal leže na ekvipotencijalnim plohama.
Za električni naboj q električni potencijal V neke točke na udaljenosti r iznosi:
Budući da je razlika potencijala među dvjema točkama u elektrostatičkom polju jednaka električnom naponu među tim točkama, to će u elektrostatici, gdje naboji miruju, sve točke nekog vodiča biti na istom električnom potencijalu, jer bi inače zbog napona došlo do gibanja naboja. Iz odnosa Uab = Va – Vb proizlazi da se električni potencijal i električni napon mjere istom mjernom jedinicom volt (V), a jakost električnog polja mjeri se u voltima po metru (V/m).
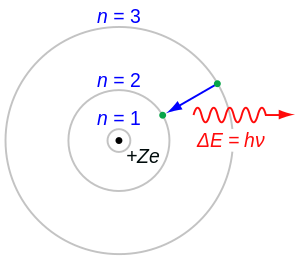
Elektron je prva otkrivena subatomska čestica. Kako bi objasnili Faradayev zakon elektrolize i atomsku strukturu materije, George Johnstone Stoney i Hermann von Helmholtz pretpostavili su (1881.) da se elektricitet pojavljuje samo u višekratnicima osnovnog iznosa. Godine 1891. Johnstone Stoney je predložio naziv elektron za osnovni iznos električnoga naboja. Poslije se taj naziv počeo primjenjivati za čestice u katodnom zračenju, to jest za čestice atomskog omotača. Katodno zračenje čine snopovi iz katode izbačenih atomskih elektrona u katodnoj cijevi. Otkrio ga je Julius Plücker 1858., ali je konačna spoznaja da su to snopovi nabijenih čestica uslijedila tek potkraj 19. stoljeća. Otklanjanje katodnog zračenja u magnetskom polju (William Crookes, Jean Baptiste Perrin) dalo je naznake da ga čine negativno nabijene čestice. Godine 1896. Hendrik Antoon Lorentz je objašnjavao cijepanje spektralnih linija u magnetskom polju (Zeemanov učinak) pretpostavkom o elektronu kao sastavnom dijelu atoma. Pokusi Josepha Johna Thomsona pokazali su da je specifični električni naboj (e/m) čestica u katodnom zračenju neovisan o materijalu katode i o načinu na koji su čestice izbačene; i da je masa elektrona oko 1/1840 dio mase vodikova atoma. Thomsonovi radovi i zaključak da je elektron sastavna čestica svih atoma smatraju se otkrićem elektrona (1897.). Točan iznos elementarnoga električnog naboja elektrona izmjerio je Robert Andrews Millikan (1909.). James Clerk Maxwell u svojoj je teoriji elektromagnetizma otkrio da je elektromagnetsko polje tromo. Na osnovi te teorije Lorentz je 1895. elektron zamislio kao kuglicu u kojoj je električni naboj, a okružena je električnim poljem ukupne energije E. Na osnovi Einsteinove relacije E = mc², pretpostavivši dakle da je tromost (masa) elektrona posljedica tromosti njegova električnog polja, Lorentz je izračunao (takozvani klasični) polumjer elektrona r = e²/mec² = 2,82 · 10–15 m. Ernest Rutherford je otkrio atomsku jezgru (1911.), Niels Bohr (1913.) je postavljanjem kvantnih uvjeta za gibanje elektrona objasnio stabilnost i jednakost atoma i optičke spektre.
Kvantna mehanika (Louis de Broglie 1924., Werner Karl Heisenberg, Erwin Schrödinger 1925.) pronalazi novo svojstvo elektrona: valno gibanje, koje potvrđuje difrakcija elektrona na kristalnoj rešetki. Elektron se ponaša kao val (dualizam), kojemu je valna duljina određena de Broglieovom relacijom λ = h/mev i kao mali zvrk sa spinom h/4π i magnetskim momentom eh/4πmec (George Eugene Uhlenbeck 1925.) te da se u višeatomskim sustavima elektroni raspoređuju u dozvoljena kvantna stanja samo po jedan u pojedino stanje (Paulijevo načelo).
Relativistička kvantna mehanika (Paul Dirac, 1928.) donosi Diracovo otkriće simetrije s obzirom na izmjenu električnoga naboja čestice. Dirac pretpostavlja postojanje pozitrona (pozitivno nabijenog elektrona, to jest antielektrona). Carl David Anderson je otkrio 1932. pozitrone u kozmičkom zračenju. Primjenjujući kvantne zakone na elektromagnetsko polje, Wolfgang Pauli postavio je (1928.) Paulijevo načelo, tvrdnju da se svaki elektron u atomu nalazi u drugome kvantnom stanju. Mjerenje pomaka dvaju stanja u vodiku, takozvanog Lambova pomaka (Willis Eugene Lamb 1947.), i precizno mjerenje magnetskoga momenta elektrona (Polykarp Kusch i Henry Foley 1947.) utvrdili su malo (0,12%) odstupanje od Diracove teorije. Moderna mjerenja magnetizma elektrona najpreciznija su mjerenja uopće. Nobelova nagrada za fiziku za godinu 1989. dodijeljena je Hansu Georgu Dehmeltu za mjerenje magnetizma elektrona s točnošću od dvanaest znamenki. Kvantna elektrodinamika objasnila je na primjer proizvodnju parova elektron-pozitron s pomoću fotona veće energije i Comptonov učinak.
Elektronska teorija[uredi | uredi kôd]
Poznato je da su najmanje čestice materije molekule i atomi. Međutim, atom nije nedjeljiv, kako se prije to mislilo, već se sastoji od atomske jezgre oko koje kruže velikim brzinama još manje čestice koje se zovu elektroni. Atom možemo usporediti sa Sunčevim sustavom u kojem planeti kruže oko Sunca. Atomi su sastavljeni od atomske jezgre i elektrona koji kruže oko te jezgre, samo se međusobno razlikuju po veličini jezgre i po broju elektrona. Najjednostavniji atom je atom kemijskog elementa vodika kod kojeg oko jezgre kruži samo jedan elektron. Najveći je atom koji se nalazi u prirodi atom elementa uranija kod kojeg oko jezgre kruže 92 elektrona.
Elektron je najsitnija negativna čestica u atomu, to jest on je negativno električan, dok je atomska jezgra pozitivno električna.
Ima tvari kod kojih su elektroni u atomu čvrsto vezani uz atomsku jezgru tako da se ne mogu od nje odijeliti na jednostavan način. Te tvari nisu sposobne za vođenje elektriciteta (električni izolatori). Kovine imaju takav sastav da kod njih nisu svi elektroni vezani uz atomsku jezgru, već ima i slobodnih elektrona koji se lako gibaju između molekula kovine. Električna struja je usmjereno gibanje slobodnih elektrona.
Ako neko fizikalno tijelo ima potpun broj svojih elektrona, kaže se da je to tijelo električni neutralno. Zbog različitih okolnosti atom nekog tijela može izgubiti nešto od svojih slobodnih elektrona, pa će ostatak atoma biti pozitivno električan. U protivnom slučaju, ako atom primi nešto suvišnih elektrona, on će biti negativno električan. Ovakvi, električki nabijeni atomi, bilo pozitivno ili negativno, zovu se ioni. Ima, dakle, pozitivnih i negativnih iona. Pozitivni ioni zovu se kationi jer se gibaju prema negativnoj elektrodi ili katodi, a negativni ioni zovu se anioni jer se gibaju prema pozitivnoj elektrodi ili anodi. Ionizirani mogu biti ne samo pojedini atomi nego i međusobno povezane grupe od dva ili više atoma. To su složeni ili kompleksni ioni.[5]
Emisija elektrona[uredi | uredi kôd]
Emisija elektrona je oslobađanje elektrona iz metalnih (i nekih drugih) elektroda. Izlazak slobodnih elektrona iz metala sprječava energijska barijera (površinska struktura koja elektronima onemogućava prijelaz bez utroška određene energije). Elektron može izaći iz površine elektrode tek kada njegova energija postane veća od izlaznoga rada (energija koju elektron mora utrošiti kako bi izišao iz metala) što se postiže zagrijavanjem, obasjavanjem i drugim.
Termionska emisija[uredi | uredi kôd]
Termionska emisija ili termoionska emisija postiže se grijanjem (žarenjem) elektrode (katode). Za tu su emisiju, koja se primjenjuje u elektronskim cijevima, osobito prikladni materijali volfram, torij, barij, ponekad pokriveni oksidima.
Fotoelektrična emisija[uredi | uredi kôd]
Fotoelektrična emisija nastaje kada fotoni svjetlosti koja pada na površinu elektrode (fotokatode) predaju svoju energiju elektronima i time omoguće njihov izlazak. Slično djeluju i druga zračenja.
Sekundarna emisija[uredi | uredi kôd]
Sekundarna emisija nastaje kada se energija iona, nestabilnih atoma ili ubrzanih elektrona (energije 10 do 20 eV) prenese na elektrone metalnih elektroda, koji nakon ulijetanja tih čestica na elektrodu izlaze u većem broju iz nje.
Emisija električnim poljem[uredi | uredi kôd]
Emisija električnim poljem nastupa kada na hladnu elektrodu djeluje vanjsko električno polje velike jakosti. U tom slučaju elektroni kroz energijsku barijeru prolaze tuneliranjem. Oštri bridovi i šiljci pomažu takvu emisiju.
Elektronski uhvat[uredi | uredi kôd]
Elektronski uhvat je obratni ili inverzni β (beta) proces kao dio univerzalnoga slabog međudjelovanja elementarnih čestica, pri kojem atomska jezgra apsorbira elektron iz atomske ljuske (najčešće K-ljuske, pa se govori o K-uhvatu) uz emisiju neutrina:
- p + e− → n + νe
Na tom se procesu temelji opažanje supernove, gdje udarni val emitiranih neutrina raznese zvjezdani plašt. Elektroni mogu biti uhvaćeni i u orbitu atoma, molekule ili iona.[6]
Izvori[uredi | uredi kôd]
- ↑ P.J. Mohr, B.N. Taylor, and D.B. Newell: "The 2014 CODATA Recommended Values of the Fundamental Physical Constants". This database was developed by J. Baker, M. Douma, and S. Kotochigova. National Institute of Standards and Technology, Gaithersburg, MD 20899.
- ↑ elektron, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
- ↑ električni naboj (količina elektriciteta), [2] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
- ↑ Coulombov zakon, [3] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2015.
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ↑ elektronski uhvat, [4] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||














