Fluoroantimonska kiselina
Fluoroantimonska kiselina (HSbF6) je smjesa fluorovodika i antimonova pentafluorida u različitim omjerima.[1] Omjer 1:1 stvara najjaču poznatu superkiselinu koja dokazano protonira i ugljikovodike stvarajući karbokatione i H2.[2]
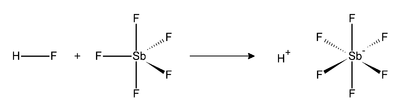
Reakcija fluorovodika (HF) i SbF5 je egzotermna. HF, kao Lewisova baza, napada molekule SbF5 kako bi stvorio adukt. U molekuli HSbF6, anion je koordiniran prema vodiku iako se smatra nekoordiniranim, jer su oba vrlo slabi nukleofili i vrlo slabe baze. Unatoč protonuvu atributu "slobodan", on je u stvari uvijek vezan za fluor vrlo slabom kovalentnom vezom, slično vodikovu kationu.[3] Međutim, jačina te veze potječe od ekstremne kiselosti sustava. Fluoroantimonska kiselina je 2×1019 (20 kvintilijuna) puta jača od 100% sumporne kiseline.[4] Kiseli proton lako preskače različite skupine aniona, primjerice Grothussovim mehanizmom. Ova kiselina je bezbojna tekućina.
Struktura[uredi | uredi kôd]
Dva su povezana produkta bila kristalizirana iz HF-SbF5 smjese, i oba su analizirana rendgenskom kristalografijom. Formule tih soli su: [H2F+][Sb2F11−] I [H3F2+][Sb2F11−]. U obje soli anion je Sb2F11−.[5] Kao što je spomenuto gore, SbF6− je kategoriziran kao slaba baza; veći monoanion Sb2F11− pretpostavlja se kao još slabiji.
Usporedba s drugim kiselinama[uredi | uredi kôd]
Sljedeće vrijednosti [nedostaje izvor] osnivaju se na Hammettovoj funkciji kiselosti. Kiselost je iskazana velikim negativnim vrijednostima H0.
- fluoroantimonska kiselina (1990.) (H0 Value = −31.3)
- čarobna kiselina (1974.) (H0 Value = −19.2)
- karboranska superkiselina (1969.) (H0 Value = −18.0)
- fluorosumporna kiselina (1944.) (H0 Value = −15.1)
- trifluorometansulfonska kiselina (1940.) (H0 Value = −14.9)
Primjene[uredi | uredi kôd]
Ova izvanredno jaka kiselina protonira gotovo sve organske spojeve. 1967. Bickel i Hogeveen pokazali su da će HF-SbF5 ukloniti H2 iz izobutana i metan iz neopentana:[6][7]
- (CH3)3CH + H+ → (CH3)3C+ + H2
- (CH3)4C + H+ → (CH3)3C+ + CH4
Sigurnost[uredi | uredi kôd]
HF-SbF5 munjevito i eksplozivno disocira u vodi. Teoretski reagira s gotovo svim poznatim otapalima.[1] Otapala koja su dokazano kompatibilna s HF-SbF5 jesu SO2ClF, akvatizirani sumporov dioksid i klorofluorougljici. Spremnici za HF-SbF5 napravljeni su od PTFE-a.
Izvori[uredi | uredi kôd]
- ↑ a b Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X. 2001. Paquette, L. (ur.). Hydrogen Fluoride–Antimony(V) Fluoride. Encyclopedia of Reagents for Organic Synthesis. J. Wiley & Sons. New York. doi:10.1002/047084289X.rh037m. Inačica izvorne stranice arhivirana 30. listopada 2015. Pristupljeno 4. kolovoza 2012.
- ↑ Olah, G. A. 2001. A Life of Magic Chemistry: Autobiographical Reflections of a Nobel Prize Winner. John Wiley and Sons. str. 100–101. ISBN 0-471-15743-0
- ↑ Klein, M. L. 25. listopada 2000. Getting the Jump on Superacids (PDF). Pittsburgh Supercomputing Center (PSC). Inačica izvorne stranice (pdf) arhivirana 31. svibnja 2012. Pristupljeno 15. travnja 2012.
- ↑ Olah, G. A. 2005. Crossing Conventional Boundaries in Half a Century of Research. Journal of Organic Chemistry. 70 (7): 2413–2429. doi:10.1021/jo040285o. PMID 15787527
- ↑ Mootz, D.; Bartmann, K. 1988. The Fluoronium Ions H2F+ and H3F2+: Characterization by Crystal Structure Analysis. Angewandte Chemie, International Edition. 27 (3): 391–392. doi:10.1002/anie.198803911CS1 održavanje: više imena: authors list (link)
- ↑ Bickel, A. F.; Gaasbeek, C. J.; Hogeveen, H.; Oelderik, J. M.; Platteeuw, J. C. 1967. Chemistry and spectroscopy in strongly acidic solutions: reversible reaction between aliphatic carbonium ions and hydrogen. Chemical Communications. 1967 (13): 634–635. doi:10.1039/C19670000634CS1 održavanje: više imena: authors list (link)
- ↑ Hogeveen, H.; Bickel, A. F. 1967. Chemistry and spectroscopy in strongly acidic solutions: electrophilic substitution at alkane-carbon by protons. Chemical Communications. 1967 (13): 635–636. doi:10.1039/C19670000635CS1 održavanje: više imena: authors list (link)