Plinski zakoni







Plinski zakoni su se razvili tijekom 17. i 19. stoljeća, kada su znanstvenici počeli shvaćati da postoji kod plinova veza između tlaka, obujma i temperature. Bitno svojstvo plinova je nasumično gibanje njihovih čestica, koje nazivamo Brownovo gibanje, prema Robertu Brownu, koji je ovu pojavu po prvi puta uočio na sićušnim zrncima cvjetnog peluda na vodi, promatrajući ih ispod mikroskopa. Kinetička teorija plinova opisuje plin kao velik broj malih čestica, koje su stalno u nasumičnom kretanju.
Plinski zakoni, toplina kao energija[uredi | uredi kôd]
Razvojem termodinamike u 19. stoljeću došlo je vrijeme da se stare predodžbe o gibanjima atoma upotrijebe za proračun svojstva materije. Ako su vidljiva tijela građena od atoma i molekule, tada se cijelo ponašanje materije mora izvesti iz njihova gibanja. Osobine materije moraju se tada prikazati kao sveukupni rezultat učinaka golemog mnoštva nevidljivih čestica. Pred teoretske fizičare postavlja se zadaća da svu termodinamičku zakonitost prikažu kao izraz mehanike atoma. Rješenje te zadaće moglo je jedino utvrditi atomistiku i postaviti je u red klasičnih znanosti, kao što su mehanika, elektrodinamika ili optika. Veliki broj fizičara i matematičara istakao se u svladavanju tog velikog djela, osobito J. C. Maxwell, R. Clausius, L. Boltzmann i J. W. Gibbs.
Iz osnovnih jednadžbi mehanike zbirno se može proračunati ponašanje velikog mnoštva atoma. Iz usporedbe i iskustvenih osobina materije mogu se odrediti nepoznate teorijske konstante: broj i mase atoma kemijskih elemenata. Dovoljna je samo jedna takva usporedba. Slaganje s ostalim iskustvenim osobinama je tad nužno ako je atomska hipoteza ispravna. Na osnovu atomskog modela mogu se izračunati energija i tlak plina na datoj temperaturi, specifična toplina, specifična vodljivost, unutarnje trenje, brzina difuzije i tako dalje.
Avogadrov broj[uredi | uredi kôd]
S atomskog gledišta cjelokupno ponašanje materije otkriva se kao izraz jedinstvene fizičke stvarnosti - gibanje atoma. Ovo ujedinjenje svih iskustvenih svojstava materije neminovno je u nuklearnoj fizici. Od početka su fizičari najveću pozornost obratili plinovitom stanju materije jer se ono da svesti na najjednostavniji atomski model. Plin nalikuje na roj mušica koje lete na sve strane. Samo kod plemenitih plinova slobodne brze čestice su atomi. Inače su to molekule. Tako se na primjer vodikov, dušikov ili kisikov plin ne sastoje od atoma nego od molekula, građenih od dva atoma. U kemiji se za jedinicu mase uzima masa najlakšeg atoma, vodikova, ili točnije 1/16 mase kisikova atoma. U tim jedinicama, gdje za masu kisikova atoma uzimamo 16, ima vodikov atom relativnu težinu 1,008. Prednost je tako odabrane jedinice da se mase ostalih atoma većinom približuju cijelim brojevima. U kemijskim jedinicama težina vodikovih molekula iznosi 2, dušikovih 28, a kisikovih 32. Uzme li se toliko grama plina kolika je njegova molekularna težina, ta se količina zove jedan mol. U molu bilo kojeg plina nalazi se uvijek isti broj molekula. Određenje ovog temeljnog broja jedan je od glavnih zadataka atomistike.
Atomska struktura materije u fizici se prvi puta jasno očitovala u značajnom otkriću, da 2 grama vodikova plina, 28 grama dušikova plina ili 32 grama kisikova plina u jednakim posudama na istoj temperaturi pokazuju isti tlak. Prvi je A. Avogadro 1811. spoznao puni doseg te činjenice. Jednak broj molekula svakog plina vrši isti tlak. Zatvorimo li u jednake posude upravo toliko od svakog plina da oni imaju jednake tlakove, opažamo da su tada njihove količine dane jednakim brojem mola. Tu prvi puta vidimo most između kemije i fizike. Ovo atomsko jedinstvo kemije i fizike Avogadru je lebdjelo pred očima kad je izrekao zakon: "Imaju li različiti plinovi istog volumena i temperature isti tlak, tad se oni sastoje od jednakog broja molekula."
Avogadrov zakon[uredi | uredi kôd]
Avogadrov zakon tvrdi da dva spremnika idealnog plina, s jednakom temperaturom, tlakom i obujmom, sadrže jednak broj molekula. To znači da je obujam nekog spremnika, direktno proporcionalan s brojem molova (ili molekula) u tom spremniku. Za 100 kPa i 273,15 K, obujam jednog mola idealnog plina iznosi 22,414 dm3 ili 22,414 litre. Matematički se taj zakon može opisati kao:
gdje je V – obujam plina (m3), n – broj molova plina u nekom spremniku (ukupan broj molekula podijeljen s Avogadrovim brojem) i k4 – konstanta.
Boyle-Mariotteov zakon[uredi | uredi kôd]
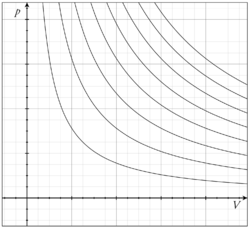
Osnovna je činjenica da je tlak plina to veći što ga na manji volumen stisnemo. Tlak je dakle obrnuto proporcionalan volumenu. Drukčije rečeno (Boyle-Mariotteov zakon):
gdje je: p - tlak plina, V - obujam ili volumen plina.
Gay-Lussacov zakon[uredi | uredi kôd]
Kad plin grijemo, njegov tlak raste. Tlak je proporcionalan temperaturi:
Odatle se vidi da se tlak plina smanjuje ako ga ohlađujemo. Postoji određena granična temperatura na kojoj tlak plina potpuno isčezava. Ta se granica zove apsolutna nula temperature. Mjerena u Celzijusovim stupnjevima ona iznosi - 273,15 °C. U fizici je običaj, da se temperatura uopće broji od te apsolutne nule. U takvoj skali je ledištu vode temperatura T = 273,15 K. Oba plinska zakona sadržani su u jednostavnom zakonu Gay-Lussaca:
ili općenito:
Odatle vidimo odmah i Boyleov zakon: "Kod konstantne temperature tlak se tako povećava kako se volumen umanjuje. Umnožak tlaka i volumena je konstantan."
Konstanta proporcionalnosti R jednaka je za sve plinove, naravno u tom slučaju gdje se uzme volumen mola. Plinska konstanta može se tako odrediti da se izmjeri tlak, volumen i temperatura plina, a dobivene vrijednosti uvrste u jednadžbu plinskog stanja. Tlak plina se izražava u njutnima po četvornom metru (N/m2) ili paskalima. Njena točna vrijednost je:
Realni plin[uredi | uredi kôd]
Jednadžba plinovitog stanja, koju smo gore zapisali, vrijedi strogo za idealni plin, to jest za plin u kojem molekule ne zapremaju nikakav prostor, niti uzajamno ne vrše nikakve sile. Međutim, realne molekule nisu matematičke točke i ne mogu se stisnuti na proizvoljno malen volumen. Uzmimo da je za zapreminu molekula u jednom molu mjerodavan neki volumen b. Očito je da će tlak plina postati beskonačno velik ako mol plina stisnemo do tog volumena b što ga same molekule zapremaju. Jednadžbu plinovitog stanja moramo prema tome izmijeniti tako da uzmemo u obzir volumen molekula:
Potrebna je još jedna važna korekcija. Između molekula vladaju slabe privlačne sile koje umanjuju tlak plina na stijenke. Djelovanje tih privlačnih sila je naravno veće ako su razmaci između molekula manji. Prema Van der Waalsu je umanjenje tlaka plina zbog privlačnih sila između molekula proporcionalno s 1/v2. Van der Waalsova jednadžba stanja glasi:
gdje je:
- p - tlak fluida;
- v - specifični obujam, a to je ukupan obujam spremnika, podijeljen ukupnim brojem čestica;
- k - Boltzmannova konstanta;
- T - apsolutna temperatura;
- a - mjera za privlačenje čestica;
- b - obujam koji zauzimaju čestice.
Van der Waalsova jednadžba dobro opisuje ponašanje realnih plinova. Usporedbom s iskustvom mogu se nepoznate konstante a i b odrediti, i ako se dobiva uvid u sile i veličine molekula).[1]
Charlesov zakon[uredi | uredi kôd]
Charlesov zakon, ili plinski zakon obujma, je objavljen 1678. godine. On govori da je obujam kod idealnog plina, kada je tlak konstantan, direktno proporcionalan apsolutnoj ili termodinamičkoj temperaturi T (u Kelvinima). Ako plinu povećavamo temperaturu, povećat će se i obujam. Matematički se taj zakon može opisati kao:
gdje je: T - apsolutna ili termodinamička temperatura (K), V – obujam plina (m3) i k2 – konstanta (u m3/K).
Kombinirani zakon i jednadžba stanja idealnog plina[uredi | uredi kôd]
Kombinirani zakon plinova se dobije kombinacijom prve 3 jednadžbe i pokazuje odnos između tlaka, obujma i temperature plina:
Ako ubacimo i Avogadrov zakon, dobije se jednadžba stanja idealnog plina:
gdje je: R – plinska konstanta, koja ima vrijednost 8,314472(15) J•K−1•mol−1. Ona se može opisati i kao:
gdje je: k – Boltzmannova konstanta, a N – ukupan broj molekula u spremniku.
Ova jednadžba je točna za idealne plinove, koja zanemaruje razne međumolekularne sile, koje djeluju kod realnih plinova. Ali, zakon idealnih plinova je vrlo dobro približenje za veliku većinu plinova, kod umjerenih tlakova i temperatura.
Iz zakona idealnih plinova mogu se izvući sljedeći zaključci:
- ako su temperatura i tlak konstantni, obujam plina je direktno proporcionalan s brojem molekula plina.
- ako su temperatura i obujam konstantni, tlak plina je direktno proporcionalan s brojem molekula plina.
- ako su temperatura i broj molekula konstantni, tlak je obrnuto proporcionalan s obujmom spremnika.
- ako je broj molekula konstantan u spremniku, s povećanjem temperature će se povećati ili tlak ili obujam (ili oboje).
Ostali plinski zakon[uredi | uredi kôd]
Daltonov zakon[uredi | uredi kôd]
Daltonov zakon tvrdi da je tlak mješavine plinova jednak zbroju parcijalnih tlakova pojedinih sastavnih dijelova mješavine. Matematički se taj zakon može opisati kao:
ili
gdje je: PTotal – ukupan tlak atmospfere, PGas – je tlak mješavine plinova u atmosferi i PH2O – tlak vodene pare, kod neke temperature.
Henryev zakon[uredi | uredi kôd]
Henryev zakon tvrdi da, kod konstantne temperature, količina otopljenog plina u tekućini, je direktno proporcionalna s parcijalnim tlakom tog plina, u ravnoteži s tekućinom.
gdje je: p – parcijalni tlak otopljene tvari u plinu iznad otopine, c – koncentracija otopljene tvari i kH – Henryeva konstanta, koja ovisi o otopljenoj tvari, otapalu i temperaturi.
Izvori[uredi | uredi kôd]
- ↑ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.
- Castka Joseph F.; Metcalfe, H. Clark; Davis, Raymond E.; Williams, John E.: "Modern Chemistry", publisher=Holt, Rinehart and Winston, 2002.
- Guch Ian: "The Complete Idiot's Guide to Chemistry", publisher=Alpha, Penguin Group Inc., 2003.
- Zumdahl Steven S.: "Chemical Principles", publisher=Houghton Millfin Company, 1998.















