Dušična kiselina: razlika između inačica
Nema sažetka uređivanja |
|||
| Redak 70: | Redak 70: | ||
==Uporaba== |
==Uporaba== |
||
==Sigurnost== |
==Sigurnost== |
||
[[Slika:Nfpa h4.png]][[Slika:Nfpa f0.png]][[Slika:Nfpa r1.png]] |
|||
[[Kategorija: Nitrati]] |
[[Kategorija: Nitrati]] |
||
Inačica od 6. studenoga 2009. u 18:24
| Dušična kiselina | |
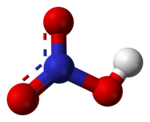 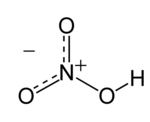
| |
| Oznake | |
| CAS broj | 7697-37-2 |
| EC broj | 231-714-2 |
| Svojstva | |
| Sistemsko ime | Dušična kiselina |
| Druga imena | Nitratna kiselina |
| Kemijska formula | HNO3 |
| Molarna masa | 63,012 g/mol |
| Izgled | Bistra, bezbojna tekućina |
| Gustoća i faza | 1,5129 g/L, plin |
| Topljivost u vodi | Mogu se miješati u svim omjerima |
| Talište | -42°C (231 K) |
| Vrelište | 83 °C (356 K) |
| Kiselost (pKa) | -1,4 |
| Dipolni moment | 2,17 D |
| Glavne opasnosti | Oksidans, korozivna. |

Dušična ili nitratna kiselina (kemijska formula HNO3) je izrazito korozivna i toksična jaka kiselina.
Koncentrirana dušična kiselina je jako oksidirajuće sredstvo.
U čistom stanju je bezbojna, ali sa starenjem postaje žućkasta zbog akumuliranja dušikovih oksida.
Obično se čuva u tamno smeđim bocama zbog fotolitičke razgradnje u dušikov tetroksid (N2O4).
Dušična kiselina otapa većinu metala čime nastaju odgovarajući nitrati. Koncentrirana dušična kiselina također reagira s nekim nemetalima čime nastaje okso kiselina ili oksid.
Svojstva
Čista bezvodna dušična kiselina (100%) na sobnoj je temperaturi bezbojna tekućina gustoće 1,522 g/cm³ koja se skrućuje pri -42 °C tvoreći bijele kristale. Temperatura vrelišta je 83 °C. U prisutnosti svjetlosti, čak i pri sobnoj temperaturi, dolazi do djelomične razgradnje uz nastajanje dušikovog dioksida prema reakciji:
- 4 HNO3 → 2 H2O + 4 NO2 + O2 (72°C)
- 4 HNO3 → 2 H2O + 4 NO2 + O2 (72°C)
što znači da bi bezvodna dušična kiselina trebala biti uskladištena ispod 0°C da bi se izbjegla razgradnja.
Sinteza
Industrijska proizvodnja
Dušična kiselina proizvodi se Ostwaldovim procesom, nazvanim po njemačkom kemičaru Wilhelmu Ostwaldu. U ovom procesu bezvodni amonijak se oksidira u dušikov oksid, koji zatim reagira s kisikom iz zraka čime nastaje dušikov dioksid. On se zatim absorbira u vodi čime nastaje dušična kiselina i dušikov oksid. Dušikov oksid se zatim vraća nazad u proces. Korištenjem amonijaka dobivenog iz Haberovog procesa, konačni produkt može se proizvesti iz dušika, kisika i vodika koji su dobiveni iz zraka i prirodnog plina kao jedinih sirovina.
