Rutherfordov model atoma: razlika između inačica
Ruthefordov model atoma |
Nema sažetka uređivanja |
||
| Redak 2: | Redak 2: | ||
[[Datoteka:US Atomic Energy Commission logo.jpg|mini|desno|250px|Ruthefordov model atoma kao simbol američke agencije za atomsku energiju.]] |
[[Datoteka:US Atomic Energy Commission logo.jpg|mini|desno|250px|Ruthefordov model atoma kao simbol američke agencije za atomsku energiju.]] |
||
'''Ruthefordov model atoma''' ili '''planetarni model atoma''' je model [[atom]]a prema kojem atom svakog [[kemijski element|kemijskog elementa]] u neutralnom stanju |
'''Ruthefordov model atoma''' ili '''planetarni model atoma''' je model [[atom]]a prema kojem se atom svakog [[kemijski element|kemijskog elementa]] u neutralnom stanju sastoji od [[Električni naboj|električno pozitivne]] [[Atomska jezgra|atomske jezgre]] u kojoj je skoncentrirana gotova sva [[Relativna atomska masa|masa atoma]] i određenog broja [[elektron]]a koji se okreću oko atomske jezgre i čine omotač atoma. Ukupni negativni električni naboj elektrona jednak je pozitivnom električnom naboju atomske jezgre i zato je atom prema okolini neutralan. <ref> Akhlesh Lakhtakia: "Models and Modelers of Hydrogen", publisher=World Scientific, 1996.</ref> |
||
==Thomsonov model atoma== |
==Thomsonov model atoma== |
||
Početkom 20. stoljeća znanstvenici su spoznali da iz atoma potiču elektroni, [[alfa-čestica|alfa-čestice]], pa i [[svjetlost]] ili [[foton]]i, pa se došlo do uvjerenja da atomi imaju složenu građu. Otuda je došla misao da je potrebno |
Početkom 20. stoljeća znanstvenici su spoznali da iz atoma potiču elektroni, [[alfa-čestica|alfa-čestice]], pa i [[svjetlost]] ili [[foton]]i, pa se došlo do uvjerenja da atomi imaju složenu građu. Otuda je došla misao da je potrebno izgled građe atoma prikazati slikovito ili postaviti model atoma. |
||
Prvi pokušaj je 1903. učinio [[Joseph John Thomson]] i taj se prvi model atoma naziva [[Thomsonov model atoma]] ili '''model pudinga sa šljivama'''. Prema Thomsonovom viđenju o građi atoma, atom je električno nabijena kuglica, polumjera oko 10<sup>-10</sup> [[metar]]a, s ravnomjerno raspoređenim [[Električni naboj|električnim nabojem]], u kojoj se nalaze negativno nabijeni elektroni, koji imaju neutralan učinak na prostorni pozitivni naboj te kuglice. Pretpostavljalo se da u tom modelu atoma, elektroni titraju oko svojih ravnotežnih položaja, a prema klasičnoj elektrodinamici, elektroni koji se kreću ubrzano, zrače [[Elektromagnetsko zračenje|elektromagnetske valove]]. Thomsonov model atoma je prestavljao atom kao [[Harmonijsko titranje|harmonični oscilator]]. |
Prvi pokušaj je 1903. učinio [[Joseph John Thomson]] i taj se prvi model atoma naziva [[Thomsonov model atoma]] ili '''model pudinga sa šljivama'''. Prema Thomsonovom viđenju o građi atoma, atom je električno nabijena kuglica, polumjera oko 10<sup>-10</sup> [[metar]]a, s ravnomjerno raspoređenim [[Električni naboj|električnim nabojem]], u kojoj se nalaze negativno nabijeni elektroni, koji imaju neutralan učinak na prostorni pozitivni naboj te kuglice. Pretpostavljalo se da u tom modelu atoma, elektroni titraju oko svojih ravnotežnih položaja, a prema klasičnoj elektrodinamici, elektroni koji se kreću ubrzano, zrače [[Elektromagnetsko zračenje|elektromagnetske valove]]. Thomsonov model atoma je prestavljao atom kao [[Harmonijsko titranje|harmonični oscilator]]. |
||
Inačica od 19. kolovoza 2011. u 16:31
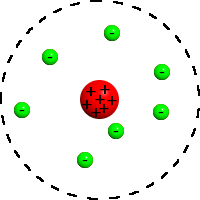

Ruthefordov model atoma ili planetarni model atoma je model atoma prema kojem se atom svakog kemijskog elementa u neutralnom stanju sastoji od električno pozitivne atomske jezgre u kojoj je skoncentrirana gotova sva masa atoma i određenog broja elektrona koji se okreću oko atomske jezgre i čine omotač atoma. Ukupni negativni električni naboj elektrona jednak je pozitivnom električnom naboju atomske jezgre i zato je atom prema okolini neutralan. [1]
Thomsonov model atoma
Početkom 20. stoljeća znanstvenici su spoznali da iz atoma potiču elektroni, alfa-čestice, pa i svjetlost ili fotoni, pa se došlo do uvjerenja da atomi imaju složenu građu. Otuda je došla misao da je potrebno izgled građe atoma prikazati slikovito ili postaviti model atoma.
Prvi pokušaj je 1903. učinio Joseph John Thomson i taj se prvi model atoma naziva Thomsonov model atoma ili model pudinga sa šljivama. Prema Thomsonovom viđenju o građi atoma, atom je električno nabijena kuglica, polumjera oko 10-10 metara, s ravnomjerno raspoređenim električnim nabojem, u kojoj se nalaze negativno nabijeni elektroni, koji imaju neutralan učinak na prostorni pozitivni naboj te kuglice. Pretpostavljalo se da u tom modelu atoma, elektroni titraju oko svojih ravnotežnih položaja, a prema klasičnoj elektrodinamici, elektroni koji se kreću ubrzano, zrače elektromagnetske valove. Thomsonov model atoma je prestavljao atom kao harmonični oscilator.
Pokus s alfa-česticama i zlatnim listićem
Thomsonov model atoma je bio na snazi sve dok na snazi sve dok Ernest Rutherford, zajedno s Hansom Geigerom i Ernestom Marsdenom, nije izveo pokus s alfa-česticama i zlatnim listićem 1909. i postavio teoriju za Rutherfordovo raspršenje, na osnovu kojeg je dokazano postojanje atomske jezgre. Pošto je Rutheford izračunao da je polumjer atomske jezgre oko 10 000 puta manji od polumjera atoma, on je zaključio da atomi nisu loptice s ravnomjernom gustoćom, već da imaju izuzetno veliku šupljikavu građu. [2]
Ruthefordov planetarni model atoma
Kako je Rutheford dokazao postojanje atomske jezgre, ostalo je još pitanje na koji način se održava ravnoteža elektrona u električnom polju njegovog atomskog jezgra. Ovaj problem je Rutheford riješio pretpostavkom da je sustav atoma sličan planetarnom Sunčevom sustavu ili da se elektroni okreću velikom brzinom oko atomskog jezgra, slično kao što se planeti okreću oko Sunca. Pri tome je centrifugalna sila svakog elektrona u ravnoteži s Coulombovom elektrostatičkom silom, kojom ga atomska jezgra privlači, koja ima smjer prema atomskom jezgru i djeluje kao centripetalna sila. Prema tome, u Ruthefordovom modelu atoma atomi se održavaju dinamičkom ravnotežom. Prema ovom viđenju iz 1911., atom se sastoji od atomskoj jezgra i elektronskog omotača kojeg čine elektroni, a između njih se nalazi praznina, u kojoj djeluju električna i magnetska polja.
Ruthefordov model atoma je napravio veliki napredak u nuklearnoj fizici, ali će on kasnije biti dopunjen s Bohrovim modelom atoma, te s radovima ostalih znanstvenika. [3]
