Natrijev hidrogenkarbonat: razlika između inačica
Nema sažetka uređivanja |
|||
| Redak 1: | Redak 1: | ||
[[Datoteka:SodiumBicarbonate.png|mini|desno|200px|Strukturna formula NaHCO<sub>3</sub>]] |
[[Datoteka:SodiumBicarbonate.png|mini|desno|200px|Strukturna formula NaHCO<sub>3</sub>]] |
||
'''Natrijev hidrogenkarbonat''' (NaHCO<sub>3</sub>) je |
'''Natrijev hidrogenkarbonat''' (NaHCO<sub>3</sub>, soda bikarbona, natrijev bikarbonat, jestiva soda, E500b ili 500ii) je bijeli kristalni prah, slabo topljiv u vodi, a vodena otopina je slabo lužnata zbog [[Hidroliza|hidrolize]].<br /> |
||
Najvažnije soli [[ugljična kiselina|ugljične kiseline]] su natrijev hidrogenkarbonat i natrijev karbonat. Te soli su od izuzetne važnosti u industrijskoj primjeni.<br /> |
|||
U kućanstvima je poznat pod nazivom soda bikarbona, dok mu je ime po IUPAC-u natrijev hidrogenkarbonat.<br /> |
|||
== Svojstva == |
|||
Zagrijavanjem se ne tali, već raspada na [[natrijev karbonat]] (Na<sub>2</sub>CO<sub>3</sub>), ugljikov(IV) oksid (CO<sub>2</sub>) i vodu (H<sub>2</sub>O).<br /> |
|||
Topljivost mu je 9.6 g u 100 mL H<sub>2</sub>O (20 °C).<br /> |
|||
U prirodi se javlja kao mineral "trona" (Na<sub>2</sub>CO<sub>3</sub>NaHCO<sub>32</sub> x H<sub>2</sub>O. |
|||
== Dobivanje == |
== Dobivanje == |
||
| ⚫ | |||
Industrijski se dobiva [[Solvayev postupak|Solvayevim postupkom]], gdje prvo nastane bikarbonat koji se potom peče dok ne prijeđe u karbonat.<br /> |
|||
| ⚫ | |||
NaCO<sub>3</sub> + CO<sub>2</sub> + H<sub>2</sub>O --> 2NaHCO<sub>3</sub> |
|||
== Uporaba == |
== Uporaba == |
||
Rabi se u proizvodnji: praška za pecivo, pjenušavih pića, u kozmetici, za sanaciju žgaravice, itd. |
|||
Koristi se u pekarstvu kao osnovni sastojak u proizvodnji raznih praškova za dizanje tijesta, prašaka za pecivo i pečenje, u kozmetici, u proizvodnji pjenušavih pića, u proizvodnji umjetnih mineralnih voda (soda voda), u proizvodnji tekstila, papira, keramike, kao punilo vatrogasnih aparata, itd.<br /> |
|||
Zbog svoje slabe lužnatosti u medicini se koristi kao neutralizirator suviška želučanih kiselina (ponajviše HCl), te za neutraliziranje kiselina, u raznim kemijskim procesima.<ref name="Hrvatska enciklopedija">[[Hrvatska enciklopedija (LZMK)]]; broj 7 (Mal-Nj), str. 602. Za izdavača: Leksikografski zavod Miroslav Krleža, Zagreb 2005.g. ISBN 953-6036-37-1</ref> |
|||
{{Commonscat|Sodium bicarbonate}} |
{{Commonscat|Sodium bicarbonate}} |
||
==Izvori== |
|||
{{izvori}} |
|||
{{Mrva-kem}} |
{{Mrva-kem}} |
||
[[Kategorija: |
[[Kategorija:Kemija]] |
||
[[Kategorija:Kemijski spojevi]] |
[[Kategorija:Kemijski spojevi]] |
||
Inačica od 2. prosinca 2013. u 17:16
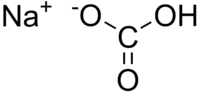
Natrijev hidrogenkarbonat (NaHCO3, soda bikarbona, natrijev bikarbonat, jestiva soda, E500b ili 500ii) je bijeli kristalni prah, slabo topljiv u vodi, a vodena otopina je slabo lužnata zbog hidrolize.
Najvažnije soli ugljične kiseline su natrijev hidrogenkarbonat i natrijev karbonat. Te soli su od izuzetne važnosti u industrijskoj primjeni.
U kućanstvima je poznat pod nazivom soda bikarbona, dok mu je ime po IUPAC-u natrijev hidrogenkarbonat.
Zagrijavanjem se ne tali, već raspada na natrijev karbonat (Na2CO3), ugljikov(IV) oksid (CO2) i vodu (H2O).
Topljivost mu je 9.6 g u 100 mL H2O (20 °C).
U prirodi se javlja kao mineral "trona" (Na2CO3NaHCO32 x H2O.
Dobivanje
Industrijski se dobiva Solvayevim postupkom, gdje prvo nastane bikarbonat koji se potom peče dok ne prijeđe u karbonat.
Osim po Solvayevu postupku natrijev hidrogenkarbonat se dobiva i uvođenjem ugljikovog(IV) oksida u vodenu otopinu natrijevog karbonata:
NaCO3 + CO2 + H2O --> 2NaHCO3
Uporaba
Koristi se u pekarstvu kao osnovni sastojak u proizvodnji raznih praškova za dizanje tijesta, prašaka za pecivo i pečenje, u kozmetici, u proizvodnji pjenušavih pića, u proizvodnji umjetnih mineralnih voda (soda voda), u proizvodnji tekstila, papira, keramike, kao punilo vatrogasnih aparata, itd.
Zbog svoje slabe lužnatosti u medicini se koristi kao neutralizirator suviška želučanih kiselina (ponajviše HCl), te za neutraliziranje kiselina, u raznim kemijskim procesima.[1]
Izvori
- ↑ Hrvatska enciklopedija (LZMK); broj 7 (Mal-Nj), str. 602. Za izdavača: Leksikografski zavod Miroslav Krleža, Zagreb 2005.g. ISBN 953-6036-37-1

