Suradnik:Drago Karlo/Stranica za vježbanje: razlika između inačica
Nema sažetka uređivanja |
Nema sažetka uređivanja |
||
| Redak 7: | Redak 7: | ||
[[File:Dipolna molekula HCl.png|thumb|250px|Dipolna molekula HCl: ''μ''=3,62·10<sup>-30</sup> Cm]] |
[[File:Dipolna molekula HCl.png|thumb|250px|Dipolna molekula HCl: ''μ''=3,62·10<sup>-30</sup> Cm]] |
||
[[File:Dipolna molekula vode.png|thumb|250px|Dipolna molekula vode: ''μ''=6,14·10<sup>-30</sup> Cm]] |
[[File:Dipolna molekula vode.png|thumb|250px|Dipolna molekula vode: ''μ''=6,14·10<sup>-30</sup> Cm]] |
||
[[File:Izračun dipola molekule vode.png|thumb|250px|Izračun dipolnog momenta molekule vode]] |
|||
[[File:3D model hydrogen bonds in water.svg|mini|250px]] |
|||
==Polarnost kemijske veze== |
==Polarnost kemijske veze== |
||
[[Kovalentna veza]] može biti polarna i nepolarna. Polarna kovalentna veza je ona čiji pripadajući elektroni nisu jednako podijeljeni između dva atoma jer ih jedan atom jače privlači nego drugi. <ref>[http://glossary.periodni.com/rjecnik.php?hr=polarna+kovalentna+veza] Generalić Eni, "Englesko-hrvatski kemijski rječnik & glosar: "Polarna molekula", 23 Feb. 2017. KTF-Split. 3 Apr. 2017.</ref> Kad se kovalentnom vezom vežu raznovrsni atomi, koji imaju različit afinitet prema elektronima, tada atom s većim afinitetom jače privuče zajednički elektronski par. Najjednostavniji primjer je veza između atoma klora i vodika u molekuli klorovodika: |
[[Kovalentna veza]] može biti polarna i nepolarna. Polarna kovalentna veza je ona čiji pripadajući elektroni nisu jednako podijeljeni između dva atoma jer ih jedan atom jače privlači nego drugi. <ref>[http://glossary.periodni.com/rjecnik.php?hr=polarna+kovalentna+veza] Generalić Eni, "Englesko-hrvatski kemijski rječnik & glosar: "Polarna molekula", 23 Feb. 2017. KTF-Split. 3 Apr. 2017.</ref> Kad se kovalentnom vezom vežu raznovrsni atomi, koji imaju različit afinitet prema elektronima, tada atom s većim afinitetom jače privuče zajednički elektronski par. Najjednostavniji primjer je veza između atoma klora i vodika u molekuli klorovodika: |
||
| Redak 33: | Redak 35: | ||
Sve što smo do sada rekli odnosi se jednako na kemijske veze kao i na molekule u cjelini, jer smo razmatrali dvoatomne molekule. Međutim dipolni moment neke kemijske veze je vektorska veličina i do dipolnog momenta složenijih molekula dolazimo na poseban način. |
Sve što smo do sada rekli odnosi se jednako na kemijske veze kao i na molekule u cjelini, jer smo razmatrali dvoatomne molekule. Međutim dipolni moment neke kemijske veze je vektorska veličina i do dipolnog momenta složenijih molekula dolazimo na poseban način. |
||
==Polarnost molekula== |
==Polarnost molekula i dipolni moment== |
||
Ukupni dipolni moment molekule može biti nula iako molekula sadrži polarne veze. To se događa ako su dipolni momenti pojedinačnih veza raspoređeni simetrično da se poništavaju. Četri C−H dipolna momenta molekule metana razmještena su simetrično u tri dimenzije i geometrijski pravilno pod istim kutovima, tako da se dipolni momenti vektorskim zbrajanjem veličina poništavaju a rezultat je nula. Molekula metana je nepolarna. |
Ukupni dipolni moment molekule može biti nula iako molekula sadrži polarne veze. To se događa ako su dipolni momenti pojedinačnih veza raspoređeni simetrično da se poništavaju. Četri C−H dipolna momenta molekule metana razmještena su simetrično u tri dimenzije i geometrijski pravilno pod istim kutovima, tako da se dipolni momenti vektorskim zbrajanjem veličina poništavaju a rezultat je nula. Molekula metana je nepolarna. |
||
Molekula vode ima svoje dvije veze pod kutem od 105°, dva dipolna momenta O−H veza po 4,3·10<sup>-30</sup> Cm, koji se ne poništavaju i zato je molekula polarna. Vektorskim zbrajanjem ova dva dipola daju rezultat od 6,14·10<sup>-30</sup> Cm za molekulu kao dipol. <ref name="ime"> P. W. Atkins, M. J. Clugston: Načela fizikalne kemije, Školska knjiga, 4.izd, Zagreb, 1996., ISBN 953-0-30908-2, str. 42-43 </ref> |
Molekula vode ima svoje dvije veze pod kutem od 105°, dva dipolna momenta O−H veza po 4,3·10<sup>-30</sup> Cm, koji se ne poništavaju i zato je molekula polarna. Vektorskim zbrajanjem ova dva dipola daju rezultat od 6,14·10<sup>-30</sup> Cm za molekulu kao dipol. <ref name="ime"> P. W. Atkins, M. J. Clugston: Načela fizikalne kemije, Školska knjiga, 4.izd, Zagreb, 1996., ISBN 953-0-30908-2, str. 42-43 </ref> |
||
| ⚫ | |||
==Polarne tvari== |
==Polarne tvari== |
||
*'''Polarnost''' je obilježje tvari čije molekule imaju stalni električni dipolni moment. Ona je posljedica građe molekula i razlike u elektronegativnosti povezanih elemenata. <ref>[http://proleksis.lzmk.hr/?s=polarnost] Leksikografski zavod Miroslav Krleža, Proleksis enciklopedija, mrežno izdanje, ožujak 2017.: Polarnost</ref> |
*'''Polarnost''' je obilježje tvari čije molekule imaju stalni ''električni dipolni moment''. Ona je posljedica građe molekula i razlike u [[Elektronegativnost|elektronegativnosti]] povezanih elemenata. <ref>[http://proleksis.lzmk.hr/?s=polarnost] Leksikografski zavod Miroslav Krleža, Proleksis enciklopedija, mrežno izdanje, ožujak 2017.: Polarnost</ref> |
||
Dakle, polarnost molekula neke tvari bitno |
Dakle, polarnost molekula neke tvari bitno utječe na svojstva te tvari koja opažamo (talište, vrelište, agregatno stanje, tvrdoća, topljivost, kristalizacija...), kažemo da je tvar polarna. |
||
===Voda=== |
===Voda=== |
||
Voda je tipična polarna tvar i ubrajamo je među '''najpolarnija otapala''' s stalnim električnim momentom koji iznosi 6,14·10<sup>-30</sup> Cm. Voda kao tvar nije jednostavan skup molekula vode. Jer su molekule vode dipoli među molekulama djeluju elektrostatske privlačne sile koje tom skupu molekula daju osobita svojstva od kojih sada razmatramo vodu kao otapalo. U vodi se dobro otapaju soli koje su ionske građe dok se ugljikovodici u vodi ne otapaju a sastavljeni su od nepolarnih molekula. Soli su ionske građe i kažemo da su soli primjer polarnih tvari. Otapanjem u vodi anioni i kationi iz soli se oslobađaju iz kristalne rešetke i mogu se gibati. Također zbog ion-dipolnog privlačenja ioni bivaju okruženi molekulama vode što nazivamo hidratacijom i nastaju hidratizirani ioni. Proces hidratacije je egzoterman što pospješuje otapanje soli. Zato pravilo otapanja glasi: "Tvari polarne građe otapaju se u polarnim otapalima." <ref name="Hab"> Habuš, Strićević, Liber: ''Opća kemija 2 : udžbenik kemije za drugi razred gimnazije'', 2. izd., Profil, Zagreb, 2008., ISBN 978-953-12-0390-6, str. 30-35.</ref> |
|||
Molekule vode se međusobno privlače znatnim međumolekulskim silama koje nazivamo '''[[Kemijska veza#Vodikova veza|vodikova veza]]'''. Snaga vodikove veze je oko 10% snage [[Kovalentna veza|kovalentne veze]]. Zbog polarnosti molekula i snage vodikove veze voda ima mnoga osobita svojstva: |
|||
*Procjenjuje se da je vrelište vode za oko 160°C više od očekivanog |
|||
*Voda je tekućina s najvećom [[Površinska napetost|površinskom napetošću]] |
|||
*Voda ima među tekućinama vrlo visok specifični [[Toplinski kapacitet|toplinski kapacitet]] |
|||
*Anomalija [[Voda|vode]], led je manje gustoće od vode pri 0°C |
|||
===Ionske tvari=== |
===Ionske tvari=== |
||
U [[Ionska veza|ionske tvari]] ubrajamo razne soli, hidrokside, neke kompleksne spojeve jer su njihovi kristali građeni od iona. Topljivost tih tvari u vodi je dobra dok se iste slabo ili nikako ne otapaju u nepolarnim otapalima (benzen, benzin, tetraklormetan, eteri). Ionske tvari možemo smatrati izrazito polarnim tvarima; kada neka polarna kovalentna veza postane najpolarnija što je moguće (teorijski), zapravo imamo ionsku vezu. |
|||
===Svojstva tvari=== |
|||
| ⚫ | |||
[[File:Dipole molecules.svg|250px]] |
|||
==Izvori== |
==Izvori== |
||
Inačica od 4. travnja 2017. u 23:17
| Dobrodošli na stranicu za vježbanje. | |
|---|---|

|
Molimo, svakako pogledajte uvodni tečaj i stranice pomoći i upoznajte se s osnovama uređivanja prije početka rada na ovoj stranici. Ovo je vaša osobna stranica za vježbanje, nije članak Wikipedije. Na njoj možete isprobati što ste naučili iz navedenih stranica, ili ju rabiti za pripremu članka koji želite postaviti na Wikipediju. I za ovu stranicu vrijede pravila Wikipedije, stoga nemojte stavljati sadržaj koji narušava autorska prava, koji je uvredljiv ili napadački na neki drugi način. Jednostavno, počnite raditi u donjem okviru za uređivanje (ako nije otvoren, kliknite ovdje). Klikom na Prikaži kako će izgledati ispod polja možete vidjeti djelovanje vašeg uređivanja. Nastavite s vježbanjem dok ne budete zadovoljni izgledom stranice. Stranicu možete spremiti klikom na Sačuvaj stranicu i nastaviti rad kasnije. |
Prostor za vježbanje
POLARNOST




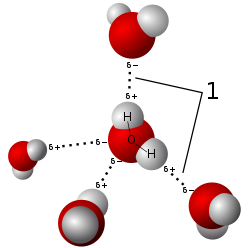
Polarnost kemijske veze
Kovalentna veza može biti polarna i nepolarna. Polarna kovalentna veza je ona čiji pripadajući elektroni nisu jednako podijeljeni između dva atoma jer ih jedan atom jače privlači nego drugi. [1] Kad se kovalentnom vezom vežu raznovrsni atomi, koji imaju različit afinitet prema elektronima, tada atom s većim afinitetom jače privuče zajednički elektronski par. Najjednostavniji primjer je veza između atoma klora i vodika u molekuli klorovodika:
- • atom klora jače privlači zajednički elektronski par: ( i označuju male naboje)
Time dolazi do asimetrične raspodjele negativnog naboja u vezi, čime jedan kraj veze postaje relativno negativno nabijen () a drugi relativno pozitivno nabijen ().
U kovalentnim molekulama zbog razlika u elektronegativnosti atoma dolazi do spomenute nejednakomjerne raspodjele elektrona, odnosno do razdvajanja težišta pozitivnog i negativnog naboja te takva molekula ima dva pola pozitivni i negativni. To su polarne ili dipolne molekule odnosno skraćeno dipoli. Zato takva kovalentna veza ima djelomično ionsku prirodu. Znači, ako je razlika elektronegativnosti atoma u molekuli veća, elektronski par je bliže elektronegativnijem atomu i pritom je molekula jače polarna, stupanj ionske veze je veći.
Stupanj dipolnog karaktera kovalentne veze može se eksperimentalno odrediti mjerenjem jakosti dipola. Mjerenje se osniva na orijentaciji dipolnih molekula u električnom polju. Negativan pol molekule usmjeri se prema pozitivnom električnom polju a pozitivan pol molekule obrnuto. Jakost dipola izražavamo električnim dipolnim momentom (μ), koji je jednak umnošku naboja (e) i razmaka između težišta naboja (l):
Električni dipolni moment molekula Molekula HF HCl HBr HI / 10-30 Cm 6,41 3,62 2,60 1,27 % ionskog karaktera 44 18 12 5
Dipolni karakter molekula opada od HF do HI. Drugim riječima najveći djelomični ionski karakter veze ima molekula HF a najmanji HI. Kad bi veza između atom klora i vodika bila čisto ionskog karaktera, onda bi molekula HCl imala dipolni moment:[2]
- gdje je naboj elektrona 1,60·10-19 C
Dipolni moment H2 je nula jer je veza nepolarna. Dipolni moment O−H veze dolazi od njene polarnosti i ima vrijednost 4,3·10-30 Cm, što je više od vrijednosti dipolnog momenta za Cl−H vezu.
Sve što smo do sada rekli odnosi se jednako na kemijske veze kao i na molekule u cjelini, jer smo razmatrali dvoatomne molekule. Međutim dipolni moment neke kemijske veze je vektorska veličina i do dipolnog momenta složenijih molekula dolazimo na poseban način.
Polarnost molekula i dipolni moment
Ukupni dipolni moment molekule može biti nula iako molekula sadrži polarne veze. To se događa ako su dipolni momenti pojedinačnih veza raspoređeni simetrično da se poništavaju. Četri C−H dipolna momenta molekule metana razmještena su simetrično u tri dimenzije i geometrijski pravilno pod istim kutovima, tako da se dipolni momenti vektorskim zbrajanjem veličina poništavaju a rezultat je nula. Molekula metana je nepolarna.
Molekula vode ima svoje dvije veze pod kutem od 105°, dva dipolna momenta O−H veza po 4,3·10-30 Cm, koji se ne poništavaju i zato je molekula polarna. Vektorskim zbrajanjem ova dva dipola daju rezultat od 6,14·10-30 Cm za molekulu kao dipol. [3]
Polarne tvari
- Polarnost je obilježje tvari čije molekule imaju stalni električni dipolni moment. Ona je posljedica građe molekula i razlike u elektronegativnosti povezanih elemenata. [4]
Dakle, polarnost molekula neke tvari bitno utječe na svojstva te tvari koja opažamo (talište, vrelište, agregatno stanje, tvrdoća, topljivost, kristalizacija...), kažemo da je tvar polarna.
Voda
Voda je tipična polarna tvar i ubrajamo je među najpolarnija otapala s stalnim električnim momentom koji iznosi 6,14·10-30 Cm. Voda kao tvar nije jednostavan skup molekula vode. Jer su molekule vode dipoli među molekulama djeluju elektrostatske privlačne sile koje tom skupu molekula daju osobita svojstva od kojih sada razmatramo vodu kao otapalo. U vodi se dobro otapaju soli koje su ionske građe dok se ugljikovodici u vodi ne otapaju a sastavljeni su od nepolarnih molekula. Soli su ionske građe i kažemo da su soli primjer polarnih tvari. Otapanjem u vodi anioni i kationi iz soli se oslobađaju iz kristalne rešetke i mogu se gibati. Također zbog ion-dipolnog privlačenja ioni bivaju okruženi molekulama vode što nazivamo hidratacijom i nastaju hidratizirani ioni. Proces hidratacije je egzoterman što pospješuje otapanje soli. Zato pravilo otapanja glasi: "Tvari polarne građe otapaju se u polarnim otapalima." [5]
Molekule vode se međusobno privlače znatnim međumolekulskim silama koje nazivamo vodikova veza. Snaga vodikove veze je oko 10% snage kovalentne veze. Zbog polarnosti molekula i snage vodikove veze voda ima mnoga osobita svojstva:
- Procjenjuje se da je vrelište vode za oko 160°C više od očekivanog
- Voda je tekućina s najvećom površinskom napetošću
- Voda ima među tekućinama vrlo visok specifični toplinski kapacitet
- Anomalija vode, led je manje gustoće od vode pri 0°C
Ionske tvari
U ionske tvari ubrajamo razne soli, hidrokside, neke kompleksne spojeve jer su njihovi kristali građeni od iona. Topljivost tih tvari u vodi je dobra dok se iste slabo ili nikako ne otapaju u nepolarnim otapalima (benzen, benzin, tetraklormetan, eteri). Ionske tvari možemo smatrati izrazito polarnim tvarima; kada neka polarna kovalentna veza postane najpolarnija što je moguće (teorijski), zapravo imamo ionsku vezu.
Polarnost organskih spojeva
Izvori
- ↑ [1] Generalić Eni, "Englesko-hrvatski kemijski rječnik & glosar: "Polarna molekula", 23 Feb. 2017. KTF-Split. 3 Apr. 2017.
- ↑ Filipović, Lipanović: "Opća i anorganska kemija", 9. izd., Školska knjiga, Zagreb, 1995., ISBN 953-0-30907-4, str.255-257
- ↑ P. W. Atkins, M. J. Clugston: Načela fizikalne kemije, Školska knjiga, 4.izd, Zagreb, 1996., ISBN 953-0-30908-2, str. 42-43
- ↑ [2] Leksikografski zavod Miroslav Krleža, Proleksis enciklopedija, mrežno izdanje, ožujak 2017.: Polarnost
- ↑ Habuš, Strićević, Liber: Opća kemija 2 : udžbenik kemije za drugi razred gimnazije, 2. izd., Profil, Zagreb, 2008., ISBN 978-953-12-0390-6, str. 30-35.







