Etin: razlika između inačica
m uklonjena promjena suradnika 109.245.175.105 (razgovor), vraćeno na posljednju inačicu suradnika MaGaBot Oznaka: brzo uklanjanje |
m zamjena čarobnih ISBN poveznica predlošcima (mw:Requests for comment/Future of magic links) i/ili općeniti ispravci |
||
| Redak 17: | Redak 17: | ||
Etin može ragirati s jakim bazama kao kiseline, odnosno zamijeniti vodikov atom s metalom, čime nastaju [[acetilid]]i. Primjer je reakcija između etina i [[Tollensov reagens|Tollensovog reagensa]], čime nastaje [[srebrov etinid]] (srebrov acetilid): |
Etin može ragirati s jakim bazama kao kiseline, odnosno zamijeniti vodikov atom s metalom, čime nastaju [[acetilid]]i. Primjer je reakcija između etina i [[Tollensov reagens|Tollensovog reagensa]], čime nastaje [[srebrov etinid]] (srebrov acetilid): |
||
:<math>\mathrm{C_2H_2 + 2 \ [Ag(NH_3)_2]^{+} + 2 \ NO_3^- \longrightarrow Ag_2C_2 \ + 2 \ NH_4NO_3 + 2 \ NH_3}</math> |
:<math>\mathrm{C_2H_2 + 2 \ [Ag(NH_3)_2]^{+} + 2 \ NO_3^- \longrightarrow Ag_2C_2 \ + 2 \ NH_4NO_3 + 2 \ NH_3}</math> |
||
Etinidi teških metala vrlo su osjetljivi eksplozivi. |
Etinidi teških metala vrlo su osjetljivi eksplozivi. |
||
| ⚫ | |||
| ⚫ | |||
Etin može ragirati s jakim bazama kao kiseline, odnosno zamijeniti vodikov atom s metalom, čime nastaju acetilidi. |
Etin može ragirati s jakim bazama kao kiseline, odnosno zamijeniti vodikov atom s metalom, čime nastaju acetilidi. |
||
Primjer je reakcija između etina i Tollensova reagensa, čime nastaje srebrov acetilid. U slučaju da su u pitanju soli "teških" metala (Cu, Ag) spojevi su neobično eksplozivni i osjetljivi. Prilikom eksplozije tlak stvaraju čestice ugljika koji pri tom nastaje. |
Primjer je reakcija između etina i Tollensova reagensa, čime nastaje srebrov acetilid. U slučaju da su u pitanju soli "teških" metala (Cu, Ag) spojevi su neobično eksplozivni i osjetljivi. Prilikom eksplozije tlak stvaraju čestice ugljika koji pri tom nastaje. |
||
Dolazi u trgovinu otopljen u [[aceton]]u pod tlakom od 12 do 15 bara, u čeličnim bocama napunjenim šupljikavom masom (''disu-plin'', prema franc. ''acetylene dissous'': otopljeni acetilen). |
Dolazi u trgovinu otopljen u [[aceton]]u pod tlakom od 12 do 15 bara, u čeličnim bocama napunjenim šupljikavom masom (''disu-plin'', prema franc. ''acetylene dissous'': otopljeni acetilen). |
||
Kataliziranom reakcijom etina i vode, uz pomoć katalizatora kao što je [[živin(II) sulfat]], nastaje [[acetaldehid]] (etanal) koji se može oksidirati u [[Octena kiselina|octenu kiselinu]] (etanoatnu kiselinu) ili reducirati u [[etanol]].<br /> |
Kataliziranom reakcijom etina i vode, uz pomoć katalizatora kao što je [[živin(II) sulfat]], nastaje [[acetaldehid]] (etanal) koji se može oksidirati u [[Octena kiselina|octenu kiselinu]] (etanoatnu kiselinu) ili reducirati u [[etanol]].<br /> |
||
| Redak 50: | Redak 49: | ||
Nekada se ovaj plin u smjesi s kisikom koristio u medicini za narkozu, no napušten je jer nakon buđenja ostavlja mučninu i glavobolju. |
Nekada se ovaj plin u smjesi s kisikom koristio u medicini za narkozu, no napušten je jer nakon buđenja ostavlja mučninu i glavobolju. |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
==Izvori== |
==Izvori== |
||
* [[Hrvatska enciklopedija (LZMK)]], Broj 1 (A-Bd), str. 314.. Za izdavača: Leksikografski zavod Miroslav Krleža, Zagreb 1999.g. ISBN |
* [[Hrvatska enciklopedija (LZMK)]], Broj 1 (A-Bd), str. 314.. Za izdavača: Leksikografski zavod Miroslav Krleža, Zagreb 1999.g. {{ISBN|953-6036-31-2}} |
||
[[Kategorija:Ugljikovodici]] |
[[Kategorija:Ugljikovodici]] |
||
Inačica od 1. veljače 2020. u 17:42

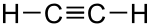
Etin (acetil- + grč. :drvo, tvar + grč. sufiks -nvn, preko engl. -ene; acetilen, C2H2) je najjednostavniji alkin.
Osobine
Acetilen je najjednostavniji nezasićeni ugljikovodik s trostrukom vezom. Prvi je član homolognoga reda alkina. Molekula etina je linearna, izgrađena od dva atoma vodika i dva atoma ugljika (C2H2).
Plin je lakši od zraka, bez boje i okusa. U čistom stanju slabo eterična, a u nečistom stanju prodorna mirisa, jer je tehnički CaC2 onečišćen fosfidima i raznim drugim spojevima.
U vodi se slabo otapa, a u organskim otapalima dobro (lako topljiv u acetonu).
Zbog opasnosti, u acetilen se dodaju neki spojevi neugodna mirisa tako da se može na vrijeme osjetiti.
Pod povišenim tlakom eksplozivan, a s nekim kovinama (bakrom, srebrom, živom) stvara vrlo eksplozivne spojeve.
Etin može ragirati s jakim bazama kao kiseline, odnosno zamijeniti vodikov atom s metalom, čime nastaju acetilidi. Primjer je reakcija između etina i Tollensovog reagensa, čime nastaje srebrov etinid (srebrov acetilid):
Etinidi teških metala vrlo su osjetljivi eksplozivi.
Zapaljen na zraku, gori lijepim, svijetlim (rijetko kad čađavim) plamenom. Goreći u atmosferi kisika (općenito pri izgaranju s kisikom) daje vruć plamen (do 3100 °C). Zbog tog svojstva se koristi u uređajima za autogeno zavarivanje i rezanje kovina.
Etin može ragirati s jakim bazama kao kiseline, odnosno zamijeniti vodikov atom s metalom, čime nastaju acetilidi. Primjer je reakcija između etina i Tollensova reagensa, čime nastaje srebrov acetilid. U slučaju da su u pitanju soli "teških" metala (Cu, Ag) spojevi su neobično eksplozivni i osjetljivi. Prilikom eksplozije tlak stvaraju čestice ugljika koji pri tom nastaje.
Dolazi u trgovinu otopljen u acetonu pod tlakom od 12 do 15 bara, u čeličnim bocama napunjenim šupljikavom masom (disu-plin, prema franc. acetylene dissous: otopljeni acetilen).
Kataliziranom reakcijom etina i vode, uz pomoć katalizatora kao što je živin(II) sulfat, nastaje acetaldehid (etanal) koji se može oksidirati u octenu kiselinu (etanoatnu kiselinu) ili reducirati u etanol.
Adicijom klorovodika acetilen daje vinil-klorid, adicijom octene kiseline vinil-acetat, a adicijom klora tetrakloretan.
Njemački kemičar W. Reppe pronašao je nove metode preradbe acetilena u važne međuproizvode organske sinteze (Reppeova acetilenska kemija).
Dobivanje
Danas se pripravlja u industriji i u laboratoriju djelovanjem vode na kalcijev karbid (CaC2):
Uporaba
Zbog svijetlog plamena, bio je korišten za osvjetljenje (tzv. karbidne lampe /svjetiljke/). Mnogo se troši za rasvjetu svjetionika.
U kemijskoj tehnici acetilen je osnovna tvar za proizvodnju velikoga broja važnih kemijskih proizvoda (npr. za pripravu acetilida).
Svi su spojevi (koji su gore opisani), a i mnogi drugi koji se iz acetilena mogu dobiti, ishodišne tvari za proizvodnju boja, lijekova, otapala, polimernih materijala, umjetnih kaučuka, itd..
Nekada se ovaj plin u smjesi s kisikom koristio u medicini za narkozu, no napušten je jer nakon buđenja ostavlja mučninu i glavobolju.
Izvori
- Hrvatska enciklopedija (LZMK), Broj 1 (A-Bd), str. 314.. Za izdavača: Leksikografski zavod Miroslav Krleža, Zagreb 1999.g. ISBN 953-6036-31-2

![{\displaystyle \mathrm {C_{2}H_{2}+2\ [Ag(NH_{3})_{2}]^{+}+2\ NO_{3}^{-}\longrightarrow Ag_{2}C_{2}\ +2\ NH_{4}NO_{3}+2\ NH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1bb510bbaf9863c30ad68c46400777ff5003e25c)
