Balmerova serija


Balmerova serija u atomskoj fizici, predstavlja jednu od emisionih spektralnih linija vodika, koja nastaje skokom elektrona iz viših kvantnih energetskih razina u niže kvantne energetske razine. Balmerovu seriju se može izračunati s Balmerovom formulom, a to je empirijska formula koju je otkrio Johann Balmer 1885.[1]
Vidljivi dio spektra vodika pokazuje četiri valne duljine: 410 nm, 434 nm, 486 nm i 656 nm, i predstavljaju emisiju fotona, koja nastaje skokom elektrona s više energetske razine na energetsku razinu 2. Jedan dio Balmerove serije je u ultraljubičastom dijelu spektra, jer je valna duljina manja od 400 nm.
Pregled[uredi | uredi kôd]
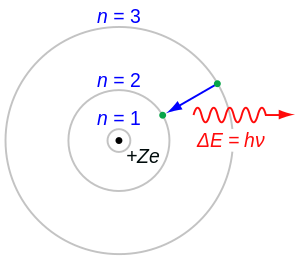
Balmerova serija predstavlja prijelaz elektrona s n ≥ 3 na n = 2, gdje je n broj energetske razine. Prvi prijelaz s 3=>2 predstavlja H-alfa, 4=>2 predstavlja H-beta, 5=>2 predstavlja H-gama, 6=>2 predstavlja H-delta itd.
| Prijelaz n | 3→2 | 4→2 | 5→2 | 6→2 | 7→2 | 8→2 | 9→2 | →2 |
|---|---|---|---|---|---|---|---|---|
| Naziv | H-α | H-β | H-γ | H-δ | H-ε | H-ζ | H-η | |
| Valna duljina (nm)[2] | 656,3 | 486,1 | 434,1 | 410,2 | 397,0 | 388,9 | 383,5 | 364,6 |
| Boja | Crvena | Cijan | Plava | Ljubičasta | (Ultraljubičasta) | (Ultraljubičasta) | (Ultraljubičasta) | (Ultraljubičasta) |
Balmerova jednadžba je pomogla stvaranju Rydbergove formulw, za cijeli spektar vodika, koja je omogućila pronalazak Lymanove serije, Paschenove serije i Brackettove serije, koje se nalaze izvan vidljivog dijela spektra.
Poznata crvena H-alfa spektralna linija plinovitog vodika, koja predstavlja prijalaz Balmerove serije s energetske razine n = 3 na n = 2, je jedna od najupadljivijih boja u svemiru. Ona doprinosi emisionom spektru ionizirajućih maglica, kao što je Orionova maglica.
Kasnije je otkriveno, kada su vodikove spektralne linije ispitane s vrlo visokom rezolucijom, da svaka linija ima svoj duplikat. To razdvajanje se naziva fina struktura.
Balmerova formula[uredi | uredi kôd]
Balmerova formula se može iskoristiti za proračun apsorbcionih i emisionih spektralnih linija atoma vodika:
gdje je:
- - valna duljina
- B - konstanta s vrijednošću 3,6456×10-7 m ili 364,56 nm.
- n - je jednak 2
- m - - cijeli broj za koji vrijedi m > n.
1888. Johannes Rydberg je iskoristio Balmerovu formula da izračuna sve spektralne linije za atom vodika, tako da je Balmerova formula specijalni slučaj Rydbergove formule:
gdje je: λ - valna duljina apsorbiranog i emitiranog svjetla, RH – Rydbergova konstanta za vodik. Rydbergova konstanta iznosi 4 / B iz Balmerove formule i ona iznosi 10 973 731,57 meter−1.[3]
Uloga u astronomiji[uredi | uredi kôd]
Balmerova serija je vrlo korisna u astronomiji, jer se Balmerove linije pojavljuju u brojnim svemirskim objektima, koji imaju vodik u sebi. Spektralna klasa zvijezda, koja se prije svega zasniva na površinskim temperaturama, zasniva se na intenzitetu spektralnih linija, a Balmerova serija je za to vrlo važna.
Kako Balmerovu seriju vidimo u mnogim svemirskim objektima, često se koristi za proračun brzine kretanja tog objekta, na osnovu Dopplerovog efekta na Balmerove linije. To se često koristi za otkrivanje dvojnih zvijezda, ekstrasolarnih planeta, kao i neutronskih zvijezda i crnih rupa. Koristi se i za galaktičke skupove i zvjezdanu prašinu poslije sudara, da bi se odredila udaljenost galaksija i kvazara, na osnovu crvenog pomaka.
U zvijezdama, Balmerove linije se vide uglavnom kao apsorpcione linije, pogotovo zvijezde koje imaju površinsku temperaturu oko 10 000 K (spektralna klasa A). Kod spiralnih i nepravilnih galaksija, aktivnih galaktičkih jezgri, H II područja i planetarnih maglica, Balmerove serije su uglavnom emisione linije.
Kod zvjezdanih spektara, Balmerova linija H-epsilon (prijelaz 7-2, 397,0 nm), se često miješa s drugom spektralnom linijom, koju stvara ionizirajući kalcij, astronomima poznata kao linija “H” (početna oznaka Fraunhoferovih linija ), koja ima valnu duljinu 396,847 nm. H-zeta Balmerova linija (prijelaz 8-2) se miješa s helijevim linijama, koje se vide kod vrućih zvijezdi.
Izvori[uredi | uredi kôd]
- ↑ C.R. Nave (2006). "HyperPhysics" Hydrogen Spectrum. Georgia State University, 2008.
- ↑ "Quantum Physics" Eisberg and Resnick, publisher=John Wiley and Sons, 1985.
- ↑ [1] "CODATA Recommended Values of the Fundamental Physical Constants: 2006", Committee on Data for Science and Technology (CODATA), publisher=NIST





