Salicilna kiselina

Salicilna kiselina je 2-hidroksibenzojeva kiselina, C6H4(OH)COOH.

Prvi je put dobivena iz vrbine kore. Nalazi se u prirodi u mnogim biljkama, i to slobodna, vezana za šećere ili u obliku estera. Djeluje jako baktericidno, pa se prije rabila kao sredstvo za konzerviranje, a danas služi kao antiseptik (sredstvo za sprečavanje rasta ili usmrćivanje mikroorganizama) u pastama za zube. Najvažnija je kao polazni spoj u proizvodnji lijekova, najviše analgetika, antipiretika i antireumatika.[1]
Povijest[uredi | uredi kôd]
Ljekovitost vrbine kore i lišća poznata je od davnina. Hipokrat je 400. god. pr. Krista preporučivao uporabu listova vrbe za liječenje očnih bolesti i ublaživanje bolova pri porođaju. O antipiretičkom učinku ekstrakta kore vrbe prvi je pred članovima Kraljevskog društva govorio velečasni Edward Stone 1763. godine. Johann Buchner, profesor farmacije iz Münchena, 1828. godine ekstrahirao je gorku, žućkastu tvar iz infuzije kore vrbe, koju je nazvao salicinom prema latinskom nazivu za vrbu (salix), a već godinu dana poslije Henri Leroux proizveo je čisti kristalni salicin. Priča se nastavila na Sveučilištu Sorbonne u Parizu, gdje je 1838. godine talijanski kemičar Raffaele Piria razdvojio salicin na šećer i aromatske spojeve kuhanjem u kiselim uvjetima. Oksidacijom tih aromatskih spojeva dobio je bezbojnu tvar koja se sastojala od dugačkih, igličastih kristala, odnosno salicilnu kiselinu. Salicilna kiselina bila je vrlo tražena, međutim, kako je nadraživala sluznicu usta, te uzrokovala gastritis i mučninu, puno godina mnogi su znanstvenici tražili rješenje za nuspojave koje je izazivala. To je uspjelo Felixu Hoffmanu - proizveo je acetilsalicilnu kiselinu, koja je uzrokovala neznatne nuspojave u usporedbi sa salicilnom kiselinom.[1]
Acetilsalicilna kiselina[uredi | uredi kôd]

Industrijsku proizvodnju salicilne kiseline usavršio je kemičar Felix Hoffmann, a farmaceutska tvrtka Bayer stavila ju je na tržište. Međutim, nedugo nakon izlaska sintetičke salicilne kiseline na tržište, počela su se pojavljivati izvješća o njezinu nadražujućem djelovanju na usta, ždrijelo i želudac. Nedugo zatim potaknuta su istraživanja kojima bi se modificirala struktura salicilne kiseline i time smanjile nuspojave, a zadržala ljekovita svojstva. Felix Hoffmann priredio je niz spojeva modificiranjem strukture 2-hidroksibenzojeve kiseline, a 1898. godine pripravio je derivat koji je bio jednako učinkovit kao i 2-hidroksibenzojeva kiselina i nije uzrokovao neugodne nuspojave. Taj je produkt bio acetilsalicilna kiselina, poznatija pod trgovačkim imenom Aspirin®.[1]
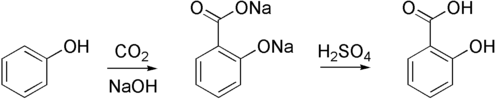
Svojstva i sinteza salicilne kiseline[uredi | uredi kôd]
Farmaceutska industrija stoga se ne oslanja na vrbu kao izvor 2-hidroksibenzojeve kiseline, nego traži načine proizvodnje željenih spojeva u laboratoriju, a potom i u industrijskim razmjerima. Da bi kemičari znali koju tvar moraju sintetizirati, moraju poznavati njezinu kemijsku strukturu. Salicilna kiselina je karboksilna kiselina te je njezina vodena otopina slabo kisela:
C6H4(OH)COOH(s) + H2O(l) ⇌ C6H4(OH)COO-(aq) + H3O+(aq)
Salicilna kiselina reagira s alkoholima, pri čemu nastaju esteri koji imaju specifičan miris, često po cvijeću ili voću. U reakciji s alkoholom metanolom daje ester metil-salicilat:
C6H4(OH)COOH(s) + CH3OH(l) ⇌ C6H4(OH)COOCH3(l) + H2O(l)
Miris metil-salicilata podsjeća na pastu za zube, žvakaću gumu ili vodicu za ispiranje usta. U prirodi je metil-salicilat sastojak biljke polegnuti zimzelen (Gaultheria procumbens L.) iz koje se dobiva zimzelenovo ulje za prehrambene, kozmetičke i medicinske svrhe. Dodatkom salicilne kiseline u otopinu željezova(III) klorida otopina se oboji intenzivnom plavoljubičastom bojom. Tim se testom dokazuje prisutnost fenolne skupine u molekuli, jer svi fenoli s ionima Fe3+ daju kompleksni spoj karakteristične boje.[1]
Pri sintezi molekula složenije građe, poput salicilne kiseline, najčešće se kao polaznim reaktantima koriste spojevi koji imaju strukturu sličnu strukturi tražene tvari i koje se može kemijski modificirati. Pri kraju 19. stoljeća fenol je bio dobro poznati spoj u farmaceutskoj industriji zbog svojih baktericidnih svojstava. Strukture fenola i 2-hidroksibenzojeve kiseline razlikuju se u jednoj funkcijskoj skupini. Problem pri sintezi 2-hidroksibenzojeve kiseline iz fenola krije se u vezanju dodatne funkcijske skupine na pravo mjesto u molekuli. Metoda kojom se sintetizira salicilna kiselina u laboratoriju poznata je kao Kolbe-Schmittova sinteza. Zagrijavanjem natrijeva fenoksida s ugljikovim dioksidom pri povišenom tlaku (100 atm, 125 °C) najprije nastaje natrijeva sol salicilne kiseline, natrijev salicilat, koja se tretira sumpornom kiselinom kako bi se dobila salicilna kiselina.[1]