Blastocista
Blastocista je struktura formirana u ranom razvoju sisavaca. Ona posjeduje unutarnju staničnu masu (ICM) koja naizgled stvara embrij i koja je također izvor embrijskih matičnih stanica. Vanjski sloj blastociste se sastoji od stanica koje se zajednički nazivaju trofoblast. Ovaj sloj okružuje unutarnju staničnu masu i šupljinu ispunjenu tekućinom, tj. blastocel. Trofoblast pridonosi stvaranju posteljice. Kod ljudi, oblikovanje blastociste počinje otprilike 5 dana nakon oplodnje, kada se tekućinom ispunjena šupljina pojavi u moruli (skup više malih, ali istih stanica). Promjer blastociste je oko 0.1-0.2 mm te uključuje 200-300 stanica kojima brzo prati brazdanje (blastulacija). Nakon otprilike 1 dan, blastocista se ugrađuje u endometrij stijenke maternice i takva će ostati u daljnjim fazama razvoja, među kojima spada gastrulacija. Korist blastociste u izvanmaterničnoj in-vitro oplodnji uključuje kulturu zigote 5 dana prije umetanja u maternicu.
Tijekom ljudske embriogeneze, blastocista se razvija iz morule u maternici 5 dana nakon oplodnje. Rani embrij (zametak) podvrgnut je diferencijacijama stanica i strukturnim promjenama da postane blastocista. Tada se priprema za implantaciju u stijenku maternice 6 dana nakon oplodnje. Implantacija označava kraj začetne faze, a označava početak embrionske faze razvoja embrija.[1]
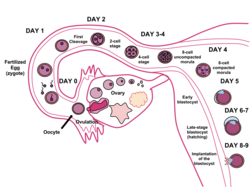
Morula, prethodnica blastociste, je rani embrij sastavljen od 16 istih stanica. Kratko nakon morulinog ulaska u maternicu iz jajovoda, morula postaje blastocista diferencijacijom stanica te kavitacijom. Stanice morule se diferenciraju u 2 tipa: unutarnju staničnu masu koja raste iznutra, na rubu, i stanice trofoblasta koje rastu izvana.[2] Strana blastociste gdje se nalazi unutarnja stanična masa se naziva životinjski pol, dok se suprotna strana naziva biljni pol. Kavitacija je proces u kojem se formira tekućinom ispunjena šupljina unutar embrija. Stanice trofoblasta izbacuju natrijeve ione u centar embrija što uzrokuje ulazak vode osmozom. Ovo oblikuje unutarnji blastocel.[3]
Implantacija je kritična za preživljavanje i razvoj ranog embrija. To stvara vezu između majke i embrija koja postoji do kraja trudnoće. Ona je omogućena zbog strukturnih promjena blastociste i stijenke endometrija.[4] "Zona pellucida" koja okružuje blastocistu puca. Takav postupak uklanja ograničenje fizičke veličine embrionske mase i izlaže vanjske stanice blastociste unutrašnjosti maternice. Uz to, hormonalne promjene majke, točnije vrh luteinizirajućeg hormona, pripremaju endometrij da primi blastocistu i obavije je. Čim postanu ograničene izvanstaničnim matriksom endometrija, stanice trofoblasta izlučuju enzime i ostale faktore da ugrade blastociste uz stijenku maternice. Ispušteni enzimi razgrađuju endometrijsko oblaganje, dok faktori za rast autokrina poput ljudskog horionskog gonadotropina (hCG) i faktor rasta sličan inzulinu (IGF) dozvoljavaju blastocisti da daljnje upada u endometrij.[5] Implantacija u stijenku maternice dozvoljava prelazak u sljedeći korak embriogeneze, gastrulaciju, koja uključuje oblikovanje posteljice iz stanica trofoblasta i diferencijaciju unutarnje stanične mase u amnionsku vreću i epiblast.
Blastocista se sastoji od stanica blastomere i blastocela. Postoje 2 tipa blastomerskih stanica:
- Unutarnja stanična masa (embrioblast) iz koje se razvijaju primitivni endoderm i epiblast.
- Trofoblast je sloj stanica koji oblikuje vanjsku stranu blastociste i koji zajedno s materničkim endometrijem stvara posteljicu. Stanice trofoblasta također izlučuju faktore koji čine blastocel.[6]
- Citotrofoblast je unutarnji sloj trofoblasta koji se sastoji od matičnih stanica koje omogućavaju razvoj stanicama, uključujući korionske resice, posteljicu i sincitiotrofoblast.
- Sincitiotrofoblast je vanjski sloj trofoblasta. Ove stanice izlučuju proteaške enzime da razbiju endometrijski izvanstanični matriks i tako da dozvole implantaciju blastociste u stijenku maternice.[7]
Blastocelska tekuća praznina sadrži aminokiseline, faktore rasta i ostale molekule potrebne za diferencijacije stanica.[8]
Mnogi procesi upravljaju specifikacijom stanica po podrijetlu da proizvedu trofoblast, epiblast i primitivni endoderm. Ovi procesi uključuju: ekspresiju gena, stanično signaliranje, kontakt stanice sa stanicom, pozicijske odnose i epigenetiku. Kada unutarnja stanična masa je uspostavljena unutar blastociste, ova stanična masa se priprema za daljnju specifikaciju u epiblast i primitivni endoderm. Ovaj proces je određivan djelomično uz pomoć signaliranja faktora rasta fibroblasta (FGF) koji stvara mitogen-aktiviranoj proteinskoj (MAP) kinazi put da promijeni stanične genome.[9] Daljnje odvajanje u trofoblast i unutarnju staničnu masu je regulirano od strane homeodomenskog proteina, Cdx2. Ovaj faktor prepisivanja potiskuje ekspresiju faktora Oct4 i Nanog u trofektoderm (trofoblast nakon gastrulacije).[10] Ove genetske izmjene dopuštaju razvojnu specifikaciju epiblasta i primitivnog endoderma po podrijetlu na kraju blastocističke faze razvoja koja prethodi gastrulaciji. Trofoblasti ekspresiraju integrin na površinama njihovih stanica što dopušta adheziju izvanstaničnog matriksa na stijenku maternice. Ovo međudjelovanje dozvoljava implantaciju i također aktivira daljnju specifikaciju u 3 različita tipa stanica, tako pripremajući blastocistu za gastrulaciju.[11]
- ↑ Sherk, Stephanie Dionne. 2006. Prenatal Development. Gale Encyclopedia of Children's Health. Inačica izvorne stranice arhivirana 1. prosinca 2013. Pristupljeno 7. prosinca 2013.
- ↑ Clinic, Mayo. 2012. Fetal development: The first trimester. Mayo Foundation for Medical Education. Pristupljeno 7. prosinca 2013.
- ↑ Gilbert SF. Developmental Biology. 6th edition. Sunderland (MA): Sinauer Associates; 2000. Early Mammalian Development. Available from: http://www.ncbi.nlm.nih.gov/books/NBK10052/
- ↑ Zhang, Shuang; Lin, Haiyan; Kong, Shuangbo; Wang, Shumin; Wang, Hongmei; Wang, Haibin; Armant, D. Randall. 2013. Physiological and molecular determinants of embryo implantation. Molecular Aspects of Medicine. 34 (5): 939–80. doi:10.1016/j.mam.2012.12.011. PMID 23290997
- ↑ Srisuparp, Santha; Strakova, Zuzana; Fazleabas, Asgerally T. 2001. The Role of Chorionic Gonadotropin (CG) in Blastocyst Implantation. Archives of Medical Research. 32 (6): 627–34. doi:10.1016/S0188-4409(01)00330-7. PMID 11750740
- ↑ James, J. L; Stone, PR; Chamley, LW. 2005. Cytotrophoblast differentiation in the first trimester of pregnancy: Evidence for separate progenitors of extravillous trophoblasts and syncytiotrophoblast. Reproduction. 130 (1): 95–103. doi:10.1530/rep.1.00723. PMID 15985635
- ↑ Vićovac, L; Aplin, JD. 1996. Epithelial-mesenchymal transition during trophoblast differentiation. Acta anatomica. 156 (3): 202–16. doi:10.1159/000147847. PMID 9124037
- ↑ Gasperowicz, M.; Natale, D. R. C. 2010. Establishing Three Blastocyst Lineages--Then What?. Biology of Reproduction. 84 (4): 621–30. doi:10.1095/biolreprod.110.085209. PMID 21123814
- ↑ Yamanaka, Y.; Lanner, F.; Rossant, J. 2010. FGF signal-dependent segregation of primitive endoderm and epiblast in the mouse blastocyst. Development. 137 (5): 715–24. doi:10.1242/dev.043471. PMID 20147376
- ↑ Strumpf, D.; Mao, CA; Yamanaka, Y; Ralston, A; Chawengsaksophak, K; Beck, F; Rossant, J. 2005. Cdx2 is required for correct cell fate specification and differentiation of trophectoderm in the mouse blastocyst. Development. 132 (9): 2093–102. doi:10.1242/dev.01801. PMID 15788452
- ↑ C.H. Damsky; Librach, C; Lim, KH; Fitzgerald, ML; McMaster, MT; Janatpour, M; Zhou, Y; Logan, SK; Fisher, SJ. 1. prosinca 1994. Integrin switching regulates normal trophoblast invasion. Development. 120 (12): 3657–66. PMID 7529679. Inačica izvorne stranice arhivirana 27. svibnja 2020. Pristupljeno 27. listopada 2014.
