Destilacija
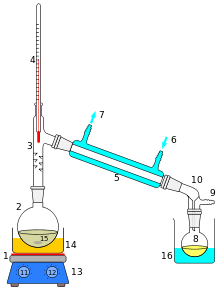
Destilacija (iz latinskog destillare „kapati“, odnosi se na kapanje kondenzata) je razdvajanje homogene smjese dviju ili više kapljevina različitih vrelišta na pojedine sastavnice. Zagrijavanjem smjese u kotlu ili destilacijskoj koloni do vrenja nastaje para bogatija sastavnicom nižega vrelišta koja je u dinamičkoj ravnoteži s kapljevitom fazom (otopina). Odvođenjem pare koja se kondenzira pri vrhu kolone ili u posebnom hladilu, kapljevita se faza uz porast temperature vrenja obogaćuje sastavnicom višega vrelišta. Jednostavnom kondenzacijom pare može se postići samo tzv. ravnotežna koncentracija.
Uporabom frakcijskih kolona, u kojima para dolazi u dodir s dijelom kondenzata koji se slijeva s vrha kolone prema dnu, postiže se bolje razdvajanje sastavnica, a ugradnjom deflegmatora između grijalice i kondenzatora koncentracija pare povećava se iznad ravnotežne. Protustrujnim vođenjem pare i kondenzata dvosastavne smjese u deflegmatoru ostaje čista sastavnica nižega vrelišta. Višesastavne smjese mogu se razdvajati na čiste sastavnice serijskim spajanjem tzv. rektifikcijskih kolona, pri čem za n sastavnica treba n-1 kolona (rektifikacija). Destilacija se primjenjuje za razdvajanje i pročišćivanje hlapljivih spojeva (proizvodnja rafiniranoga etanola, tj. rafinade, žestokih alkoholnih pića, eteričnih ulja i sl.). Destilacija tvari koje nisu postojane na temperaturama vrenja pri normalnom tlaku (npr. vitamini) provodi se u vakuumu (tzv. molekularna destilacija).
Pri suhoj destilaciji krute se tvari djelomičnim izgaranjem uz nedovoljno kisika zagrijavaju do temperature na kojoj se kemijski raspadaju i oslobađaju jednostavnije kemijske spojeve u plinovitom stanju. Tako u većinskom sastavu nastaje gorivi drvni plin, octena kiselina i metanol, a kao produkt ostaje drvni ugljen.
Azeotopna destilacija je razdvajanje smjese dviju sastavnica koje se ne mogu razdvojiti dodavanjem treće sastavnice, čime nastaje heterogena azeotropna smjesa novih svojstava, tzv. azeotrop. Promjenom tlaka mijenja se sastav para iznad azeotropa, pa se sastavnice mogu razdvojiti jednostavnom destilacijom. Sastavnice se mogu razdvojiti i tzv. ekstraktivnom destilacijom, gdje jednostavnoj destilaciji prethodi razaranje azeotropa dodatkom otapala visokoga vrelišta, koje selektivno djeluje samo na jednu od sastavnica tako da joj poveća hlapljivost (azeotropna smjesa).
Frakcijska (diferencijalna) destilacija je razdvajanje smjese tekućina na pojedine sastavnice, tj. frakcije, zasnovano na razlici njihovih vrelišta, ne većoj od 25 °C. Zagrijavanjem smjese do vrelišta pojedine frakcije, frakcija isparuje, pare se kondenziraju, pa nastaju destilati različita sastava koji se sakupljaju u zasebnim sabirnicama. Nastale pare mogu se djelomično ukapljiti te ponovno destilirati, čim nastaje destilat s većim sadržajem hlapljivijih sastavnica. Frakcijska se destilacija provodi u frakcijskim ili rektifikacijskim kolonama, a rabi se za razdvajanje sastavnica u rafinerijama nafte, petrokemiji i kemijskoj industriji, za dobivanje ugljikovodika iz nafte i prirodnoga plina, pojedinih plinova iz ukapljenoga zraka, itd.
Molekularna destilacija je destilacija u visokom vakuumu, tj. pri znatno sniženome tlaku, čime se snizuje vrelište kapljevine. Provodi se pri tlaku 0,13...0,93 Pa (u laboratorijskim uvjetima) ili 0,4...4 Pa (u industrijskim postrojenjima). Primjenjuje se za odjeljivanje sastavnica tekućih smjesa koje imaju visoko vrelište ili nisu postojane na povišenim temperaturama.
Ovo je pak destilacija pri kojoj se kao interna sastavnica rabi vodena para. Uporabom inerta (npr. dušik, ugljikov dioksid, ali najčešće vodena para, jer je lako dostupna i njime se istodobno može dovoditi toplina) snizuje se vrelište pojedinih sastavnica, pa one isparuju pri nižim temperaturama. Tako se mogu odvajati tvari koje su na visokim temperaturama nepostojane (npr. prirodne arome) ili reagiraju s ostalim sastavnicama smjese. Rabi se u kozmetičkoj industriji (proizvodnja eteričnih ulja i mirisa) u organskoj kemiji pri sintezi složenih organskih spojeva, u rafinerijama nafte i petrokemiji industriji (tzv. parno stripiranje), itd.
Tvari koje su vrlo osjetljive na toplinu mogu se odvojiti destilacijom vodenom parom u vakuumu (npr. hormoni).
- Tehnički leksikon, Leksikografski zavod Miroslav Krleža; glavni urednik: Zvonimir Jakobović. Tiskanje dovršeno 21. prosinca 2007., nacionalne i sveučilišne knjižnice u Zagrebu pod brojem 653717. ISBN 978-953-268-004-1, 141-142. str.
