Kovalentna veza

- Kovalentna veza je jedna vrsta kemijske veze pri kojoj svaki atom daje po jedan elektron koji čine zajednički elektronski par koji pripada objema jezgrama i time povezuje atome.[1]
Nastanak kemijskih veza[uredi | uredi kôd]
U prirodi sve teži minimalnoj energiji. Tako je i energija nekog kemijskog spoja manja od zbroja energija pojedinačnih elemenata (vidi dijagram). Povezivanjem atoma kemijskim vezama u spojeve nastaje stanje minimalne energije. Kemijska veza je zapravo sila koja povezuje atome u nekoj molekuli ili strukturi. Kemijskih veza ima više vrsta a koja će kemijska veza povezati atome ovisi o građi samih atoma i njihovim svojstvima. Dva su temeljna načina kako se atomi povezuju a uvijek se radi o tome da se elektroni atoma pregrupiraju. Atom može potpuno predati ili primiti jedan ili više elektrona (ionska veza), alternativno, dva atoma mogu dijeliti elektrone (kovalentna veza).
Gilbert Newton Lewis je predložio prikaz nastajanja kemijske veze simbolom atoma i točkicama koje predstavljaju vanjske ili valentne elektrone. Lewis je pretpostavio da svaki atom teži oktetnoj elektronskoj konfiguraciji, po uzoru na plemenite plinove, osim helija koji ima dubletnu konfiguraciju. Takva konfiguracija istovremeno ima najmanju energiju.[2]
Kovalentna veza između istovrsnih atoma[uredi | uredi kôd]
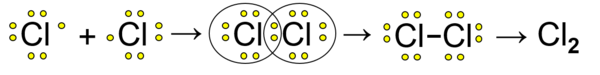



Kovalentna veza povezuje atome nemetala. Atomi nemetala imaju veliku energiju ionizacije i imaju velik elektronski afinitet, teško gube elektron, zato se takvi atomi povezuju preko zajedničkih elektronskih parova. Primjer je nastanak molekule klora, Cl2:
Svaki atom klora ima po sedam elektrona a jedan od elektrona atom daje u vezni i zajednički elektronski par. Podjelom zajedničkog elektronskog para oba su atoma postigla stabilnu elektronsku konfiguraciju plemenitog plina argona, dijeljenjem elektrona svaki atom ih ima po osam.
Približavanjem dva atoma klora njihove atomske orbitale se preklapaju i nastaje procesom hibridizacije zajednička molekulska orbitala koja sadrži vezni elektronski par, tako je nastala jednostruka kovalentna veza. U molekuli klora svaki atom ima također po tri nevezna elektronska para (crtež).
Kisik je postigao oktetnu konfiguraciju s dvama veznima elektronskim parovima i nastala je dvostruka kovalentna veza.
Dušik postiže oktetnu konfiguraciju s trima veznima elektronskim parovima i nastala je trostruka kovalentna veza. Kovalentne kemijske veze između istovrsnih atoma još se nazivaju homonuklearne i također one su nepolarne.[2]
Atomi imaju elektronsku konfiguraciju vanjske valentne ljuske koju možemo pročitati u periodnom sustavu elemenata. Približavanjem atoma njihove vanjske ljuske se počnu preklapati. Zajednički elektronski par kovalentne veze nastane u zajedničkoj molekulskoj orbitali, koja je nastala od pojedinačnih atomskih orbitala. Eksperimentalna potvrda da su parovi podijeljeni najbolje dolazi od difrakcije rendgenskih zraka. Slika uz tekst prikazuje raspored gustoće elektrona oko dvije jezgre atoma vodika u molekuli vodika. Krivulje povezuju područja iste gustoće elektrona. Najveća gustoća je oko samih jezgri a posebno je gustoća elektrona velika između dvije atomske jezgre. Elektronski par se nalazi između dvije pozitivno nabijene jezgre, on privlači obje jezgre i djeluje kao neka vrsta "elektrostatskog ljepila". To je osnovni razlog jakosti kovalentnih veza i stabilnosti molekula. [3]
Kovalentna veza između raznovrsnih atoma[uredi | uredi kôd]

Pogledajmo kako nastaju spojevi klora, kisika, dušika i ugljika s vodikom.
- Svi halogeni elementi s vodikom čine halogenovodike, molekule u kojima je uvijek vezan jedan atom halogenog elementa s atomom vodika jednostrukom vezom. Atom klora u ovom primjeru udružuje jedan elektron, atom vodika također udružuje jedan elektron u zajednički vezni par.
- Atom kisika iz 16. skupine elemenata periodnog sustava ima u valentnoj ljusci šest elektrona, zato mora s dvama atomima vodika načiniti dva vezna elektronska para, tako nastaju dvije jednostruke veze. Time je atom kisika ostvario oktet, atomi vodika su ostvarili dublet a zajedno tri atoma imaju najnižu moguću energiju.
- Atom dušika ima u valentnoj ljusci pet elektrona i zato mora s trima atomima vodika načiniti tri vezna elektronska para, tako nastaju tri jednostruke veze. Time je atom dušika ostvario oktet, atomi vodika su ostvarili dublet a zajedno četiri atoma imaju najnižu moguću energiju.
- Atom ugljika ima u valentnoj ljusci četiri elektrona i zato mora s četirima atomima vodika načiniti četiri vezna elektronska para, tako nastaju četiri jednostruke veze. Time je atom ugljika ostvario oktet, atomi vodika su ostvarili dublet a zajedno pet atoma imaju najnižu moguću energiju.
Kovalentne kemijske veze između raznovrsnih atoma još se nazivaju heteronuklearne i također one su polarne.[2]
Usmjerenost kovalentne veze u prostoru[uredi | uredi kôd]

Središnji atom neke molekule najčešće je okružen s ukupno četiri elektronska para čime taj atom postiže oktetnu konfiguraciju. Ugljik u molekuli metana vezan je s četirima atomima vodika s četirima veznim elektronskim parovima. Dušik u molekuli amonijaka vezan je s trima veznim parovima a ima i jedan elektronski par koji ne sudjeluje u stvaranju kemijske veze. Kisik je u molekuli vode vezan s dvama veznim elektronskim parovima a ima i dva elektronska para koji ne sudjeluju u kemijskoj vezi.
O broju atoma u molekuli kao i o broju veznih i neveznih elektronskih parova oko središnjeg atoma, ovise i međusobni položaji atoma u prostoru i kutovi između kovalentnih veza.
U molekuli metana sva su četiri elektronska para podijeljena. Zbog istovrsnog naboja oni se nastoje međusobno što više udaljiti. Na taj način čine najveći mogući kut u prostoru, koji je jednak između svih četiriju kovalentnih veza i iznosi 109,5°. Taj kut je tetraedarski pa i molekula metana ima oblik tetraedra. U molekuli amonijaka kut je nešto manji, iznosi 107° jer se nevezni elektronski parovi jače odbijaju od veznih. Molekula amonijaka ima oblik niske trostrane piramide. U molekuli vode kut je još manji iz istog razloga a molekula ima V-oblik. Kovalentna veza je dakle usmjerena u prostoru.[2]
Značajke kovalentne veze[uredi | uredi kôd]

Nabrojimo značajke kovalentne veze:
- Kovalentna veza povezuje atome nemetala
- Veza nastaje tvorbom zajedničkih elektronskih parova između dva atoma
- Povezivanjem atoma nastaju nove složene čestice molekule
- Veza može biti jednostruka, dvostruka i trostruka
- Kovalentna veza je prostorno usmjerena
- Snaga kovalentne veze leži u elektrostatskoj sili privlačenja između zajedničkih parova (-) i obaju jezgara (+) u vezi.
Odstupanja od pravila okteta[uredi | uredi kôd]

Ako broj parova elektrona oko središnjeg atoma odstupa od broja četiri (osam elektrona) govorimo o odstupanju od pravila okteta.
Berilijev klorid (BeCl2) kovalentna je molekula iako je berilij metal. Oko berilija nalaze se dva vezna elektronska para koja se odbijaju i atomi u molekuli su maksimalno udaljeni, kut između kovalentnih veza je 180°. Molekula je linearna.
Borov klorid (BCl3) ima tri kovalentne veze. Tri elektronska para su najviše udaljena ako su kutovi 120° među kovalentnim vezama. Molekula borova klorida je planarna.
Fosforov klorid (PCl5) ima pet kovalentnih veza. Pet elektronskih parova sadržano je u pet kovalentnih veza koje zatvaraju kutove od 90° i 120° a molekula ima oblik trigonske bipiramide.
Sumporov fluorid (SF6) ima šest kovalentnih veza. Šest kovalentnih veza sa šest elektronskih parova zatvaraju kutove 90°i 180° i veze su usmjerene prema vrhovima oktaedra.
Više od četiriju parova elektrona mogu imati samo središnji atomi koji mogu popunjavati d-orbitale.
Lewisov prikaz kemijske veze je jedan od teorijskih modela koji ne može objasniti građu složenijih molekula. To tumače novije teorije kao VSEPR - Valence shell electron pair repulsion (odbijanje elektronskih parova valentne ljuske).[2]
Duljina i energija kovalentne veze[uredi | uredi kôd]


Molekula etena (H2C=CH2) je jednostavni primjer molekule s dvostrukom vezom. Istraživanja građe molekule etena pokazala su da je ta molekula planarna tj. svi atomi leže u jednoj ravnini. Kovalentne veze međusobno zatvaraju kut od 120°. Kada se atomi vežu dvostrukom vezom, u vezi sudjeluju dva para elektrona. Jedna veza ostvaruje se preklapanjem elektronskih oblaka uzduž osi molekule. Druga veza, odnosno elektronski oblak koji pripada drugom paru elektrona, rasprostire se iznad i ispod ravnine što je čine ugljikovi i vodikovi atomi. Elektronski oblak tog drugog para elektrona je manje gustoće (više je udaljen od jezgara) pa je dvostruka veza slabija od dvije jednostruke. Zato ugljikovodici s dvostrukim vezama lakše stupaju u kemijske reakcije od onih s jednostrukim vezama. Također je utvrđeno da dijelovi molekule oko dvostruke kovalentne veze ne mogu rotirati dok za rotaciju dijelova molekule oko jednostruke veze nema prepreka.
Molekula etina (H−C≡C−H) je primjer spoja s trostrukom kovalentnom vezom. Energija trostruke veze je također manja od tri jednostruke. Energija jednostruke veze C−C je 335 kJ/mol, dvostruke C=C veze je 610 kJ/mol a trostruke C≡C veze 836 kJ/mol. Zato su ugljikovi spojevi s trostrukom vezom još reaktivniji od spojeva s dvostrukim vezama.[4]
Kod nastajanja kovalentne veze atomske orbitale dvaju atoma ulaze jedna u drugu, stoga je udaljenost između jezgara povezanih atoma uvijek manja od zbroja polumjera atoma. Udaljenost između jezgara atoma u molekuli naziva se duljinom kovalentne veze.
Duljina jednostruke C−C kovalentne veze je 154 pm, dvostruke C=C 135 pm a trostruke C≡C 120 pm. Veza je to jača što je duljima veze manja a energija veze veća. Svaka kemijska veza dakle određena je duljinom i energijom veze.[2]
Polarnost kovalentne veze[uredi | uredi kôd]

Elektronegativnost atoma je njegova sposobnosti da privuče elektronski par koji unutar molekule dijeli s drugim atomom u kovalentnoj vezi.[5]
Kovalentna veza zato može biti nepolarna i polarna. U nepolarnoj vezi između dva jednaka atoma (H2, O2, N2) nema preraspodjele naboja i atomi su električno neutralni. Veza postaje polarna kada stvaranje veze ostavlja djelomične naboje na atomima. Molekula klorovodika ima polarnu kovalentnu vezu jer dolazi do malog pomaka elektrona prema atomu klora i nastaje: (δ je oznaka male vrijednosti). To se događa zato što atomi klor i vodik imaju različitu elektronegativnost, sposobnost privlačenja zajedničkog elektronskog para. Sličan pomak događa se i u molekuli vode:. Polarnost veze znači da veza nije čisto kovalentna već ima dio ionskog karaktera.
Mjera za elektronegativnost atoma je koeficijent elektronegativnosti, χ (grčko hi), koji može imati vrijednost do 4,0. Vrijednosti koeficijenta elektronegativnosti izračunavaju se iz energije ionizacije i elektronskog afiniteta nekog atoma.
| Elektronegativnost nekih atoma | ||||||
|---|---|---|---|---|---|---|
| H: 2,20 | ||||||
| Li: 0,98 | Be: 1,57 | B: 2,04 | C: 2,55 | N: 3,04 | O: 3,44 | F: 3,98 |
| Na: 0,93 | Mg: 1,31 | Al: 1,61 | Si: 1,90 | P: 2,19 | S:2,58 | Cl: 3,16 |
Elektronegativnosti atoma omogućuju nam predviđanje stupnja polarnosti veza. Razlika elektronegativnosti kisika i vodika dovodi do pomaka elektrona prema kisiku, težišta pozitivnog i negativnog naboja u molekuli nisu na istom mjestu, molekula je polarna i ponaša se kao dipol (vidi sliku). Zato je voda izrazito polarno otapalo. Mjera polarnosti neke molekule je veličina nazvana dipolni moment.[3]
Važno je reći da polarnost molekula izrazito utječe na cijeli niz svojstava tvari: talište, vrelište, agregatno stanje, gustoća, svojstvo topljivosti, hidratacija...
Izvori[uredi | uredi kôd]
- ↑ [1] Institut za hrvatski jezik i jezikoslovlje, Strukovno nazivlje: Kovalentna veza
- ↑ a b c d e f Habuš, Tomašić, Liber: Opća kemija 1, 1. izd., Profil, Zagreb, 2014., ISBN 978-953-12-1434-6, str. 102.
- ↑ a b P. W. Atkins, M. J. Clugston: Načela fizikalne kemije, Školska knjiga, Zagreb, 1996., ISBN 953-0-30908-2, str. 34-43
- ↑ Sikirica, Korpar, Čolig: Kemija s vježbama 1, Školska knjiga, Zagreb, 2000., ISBN 953-0-20540-6, str. 122-124
- ↑ [2] Leksikografski zavod Miroslav Krleža, Hrvatska enciklopedija, mrežno izdanje: Elektronegativnost, Pristupljeno 31.3.2017.


