Esteri
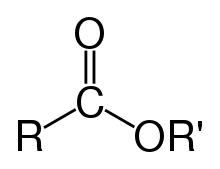
Esteri (njem. Essig-Äther, stari naziv za keton-eter) su u kemiji organske tvari u kojima organska grupa zamjenjuje jedan ili više atoma vodika u hidroksilnoj skupini. Kod estera hidroksilna skupina reagira s karboksilnom skupinom i nastaje nova skupina koja se naziva esterska -COO-. Najpoznatiji esteri su karboksilni esteri, no postoje i esteri alkohola i anorganskih kiselina, a jedan od najpoznatijih takvih je nitroglicerin. Nitroglicerin se dobiva reakcijom trovalentnog alkohola glicerola i dušične kiseline uz prisutnost sumporne kiseline.
Esteri nastali kemijskom reakcijom s karboksilnim kiselinama imaju opću formulu RCOOR’.
Naziv estera tvori se tako da ime alkohola koji je stupio u reakciju stoji prvo tj. naziv alkilne skupine alkohola (npr. naziv alkilne skupine propanola je propil) tj. umjesto završetka -anol na osnovu imena alkohola doda se nastavak -il. Druga riječ u nazivu estera potječe od kiseline, a tvori se tako da se imenu kiseline makne nastavak -ska i doda nastavak -oat (npr. druga riječ u imenu estera butanske kiseline bila bi butanoat). Kod estera s etanskom kiselinom često se umjesto etanoata koristi acetat, kod onih s metanskom kiselinom, formijat, kod estera s butanskom kiselinom koristi se i butirat, a kod propanske kiseline koristi se i propionat. I kod alkohola postoje drugi nazivi pa se tako umjesto pentil, često zna naći i amil. Opća bi formula bila: alkohol (-ol > -il) + karboksilne kiseline (-ska > -oat)
Po redoslijedu opadajućeg prioriteta pri odabiru i imenovanju glavne karakteristične skupine, esteri su sedmi po redu razredni spojevi (slijedom COOH i C(O)O2H; zatim njihovi S- i Se-derivati, pa redom sulfonske, sulfinske, selenonske itd., fosfonske, arsonske itd. kiseline).[1]
Esteri su hlapljive tekućine. Molekule estera ne mogu se međusobno povezivati vodikovim vezama pa su njihova vrelišta niža od vrelišta karboksilnih kiselina i alkohola slične molekularne mase. Polarna karbonilna skupina razlog je postojanja dipol-dipol interakcija između molekula estera. Zbog toga su njihova vrelišta, u usporedbi s ugljikovodicima sličnih molekularnih masa, viša. Molekule estera mogu se vodikovim vezama povezivati s molekulama vode. No, relativno se dobro u vodi otapaju samo esteri nižih molekularnih masa. Topljivost metil-etanoata u vodi iznosi 33 g/100 g vode, a etil-etanoata samo 8,5 g/100 g vode. Slično topljivosti alkohola i karboksilnih kiselina, topljivost nekog estera u vodi manja je što je više ugljikovih atoma u molekuli estera. Esteri se odlično otapaju u organskim otapalima (kloroform, eter, benzen i dr.), a i sami se često koriste kao organska otapala, primjerice etil-etanoat.[2]
Mnogi esteri imaju specifičan miris, te se zbog toga većinom upotrebljavaju kao umjetne arome i u proizvodnji mirisa.
- Metil-butanoat – ananas, jabuka
- Metil-benzoat – voćni miris ylang-ylang
- Etil-formijat – rum
- Etil-butanoat – ananas, jagoda
- Etil-heksanoat – grožđe
- Etil-acetat – staro vino
- Amil-acetat – banane, kruške
Triacilglicerol (masti i ulja) esteri su koji sadrže tri hidroksilne skupine. Esteri se imenuju slično kao i soli. Triacilgliceroli su tvari netopljive ili slabo topljive u vodi (lipidi).
Esteri se mogu dobiti reakcijom kiseline (obično organske) i alkohola uz prisutnost sumporne kiseline kao katalizatora, iako ima i drugih načina dobivanja estera. Esterifikacija je povratna reakcija u kojoj se esterifikacija događa istovremeno s hidrolizom, pa je potrebno higroskopno sredstvo koje bi reakciji uzelo vodu.
Alkoholi + karboksilne kiseline ↔ ester + voda (esterifikacija)
Ester + voda ↔ alkoholi + karboksilne kiseline (hidroliza)
Prirodni esteri pojavljuju se u voću, mastima, uljima i loju
Uporaba estera:
- u prehrambenoj i konditorskoj industriji
- za proizvodnju otapala i plastičnih masa
- za proizvodnju parfema

Metil-metanoat ili metil-formijat jest bezbojna tekućina s karakterističnim esterskim mirisom, lako isparava i ima malu površinsku napetost. Molekulska je formula C2H4O2.
Primjenjuje se kao insekticid i za proizvodnju nekih lijekova.
Obično nastaje na jedan od dvaju načina:
- esterifikacijom metanola i metanske kiseline:
HCOOH + CH3OH → HCOOCH3 + H2O - industrijski (kombinacija metanola i ugljikova monoksida):
CH3OH + CO → HCOOCH3

Etil-etanoat (etil-acetat) jest bezbojna, lako zapaljiva tekućina s karakterističnim, mirisom sličan ljepilima ili skidačima laka za nokte. Molekulska je formula C4H8O2.
- ledište: -83,6 °C
- vrelište: 73,1 °C
Etil-acetat zapaljiv je i iritira kožu.
Primjenjuje se:
- kao otrov za ubijanje kukaca (u entomologiji jer ubije kukca, ali ga ne uništi)
- u ljepilima i skidačima laka za nokte
- kao reagens za određivanje angiotenzin konvertirajućeg enzima (ACE).
Nastaje sintezom octene kiseline i etanola s prisutnošću jakih kiselina kao što je sumporna kiselina.
- CH3CH2OH + CH3COOH → CH3COOCH2CH3 + H2O
- ↑ E-škola, odgovorio: Tomislav Portada, PMF, arhivirano 25. lipnja 2007.
- ↑ Begović, Tajana; Luetić, Marina; Novosel, Frances; Petrović Peroković, Vesna; Rupčić Petelinc, Sonja. 2021. Kemija 4. Školska Knjiga. Zagreb. ISBN 978-953-0-22465-0

