Benzen: razlika između inačica
sređivanje |
m robot Dodaje: pnb:بینزین |
||
| Redak 90: | Redak 90: | ||
[[no:Benzen]] |
[[no:Benzen]] |
||
[[pl:Benzen]] |
[[pl:Benzen]] |
||
[[pnb:بینزین]] |
|||
[[pt:Benzeno]] |
[[pt:Benzeno]] |
||
[[ro:Benzen]] |
[[ro:Benzen]] |
||
Inačica od 16. kolovoza 2010. u 01:57
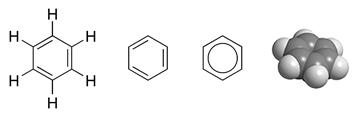
Benzen je najjednostavniji aromatski ugljikovodik. Empirijska formula mu je C6H6.[1]
Znanstvenici su dugo pokušavali odrediti strukturnu formulu. Njemački kemičar Friedrich August Kekulé von Stradonitz to je postigao tako da je naizmjenice postavio jednostruke i dvostruke veze između atoma ugljika.
Može se crtati i s jednostrukom vezom između atoma ugljika i kružnicom unutar šesterokuta što se naziva benzenov prsten. Svi aromatski ugljikovodici imaju jedan ili više benzenovih prstenova.
Dobivanje
- Frakcijskom destilacijom katrana kamenog ugljena
- Sintezom tri molekule etina (C2H2)
Svojstva
Benzen je bezbojna tekućina, jakog mirisa. Vrije na 80 °C. Pri temperaturi nižoj od 5.5°C skrućuje se u bijelu kristalnu tvar. U vodi se ne otapa, ali se otapa u organskim otapalima
Benzen otapa masti i ulja, smole i boje.
Benzenove pare su veoma otrovne i uzrokuju leukemiju. Proizvodi dobiveni iz benzena nisu otrovni kao benzen.
Lako je zapaljiv. Zapaljen gori čađavim plamenom.
- 2C6H6 + 15O2 → 12CO2 + 6H2O
Zbog postojanja jednostrukih i dvostrukih veza stupa u reakcije adicije i supstitucije.
Supstitucija:
- C6H6 + Br2 → C6H5Br + HBr
Adicija:
- C6H6 + 3Cl2 → C6H6Cl6
Upotreba
Koristi se kao otapalo, zatim za proizvodnju lijekova, boja, lakova, plastičnih masa, eksploziva, sredstava za pranje , insekticida. Benzen se sve više izbjegava u industriji jer je otrovan i jak je kancerogen. Upravo zbog njegovog štetnog djelovanja, u industriji ga zamjenjuju njegovi derivati koji nisu toliko štetni za ljudsko zdravlje, npr. toluen.
Izvori
- ↑ Tehnička enciklopedija Leksikografskog zavoda Miroslav Krleža, Zagreb, svezak 1, str. 418
Predložak:Link FA
Predložak:Link FA
Predložak:Link FA
Predložak:Link FA
