Boyle-Mariotteov zakon
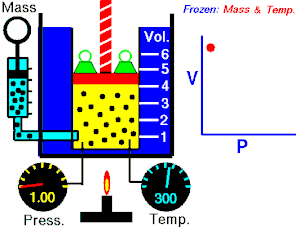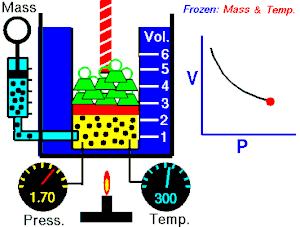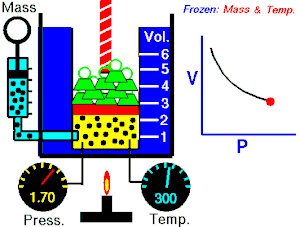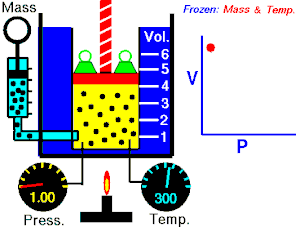

Boyle-Mariotteov zakon opisuje istodobnu izotermnu (T = konstantno) promjenu tlaka i volumena plina. Volumen plina mijenja se s tlakom prema jednakosti:
odnosno:
za stalnu temperaturu (T = konstantno). Vrijednost konstante ovisi o temperaturi i količini plina. Dakle, na stalnoj temperaturi tlak i volumen plina obrnuto su razmjerni u zatvorenom plinskom sustavu. U p-V dijagramu Boyle-Mariotteov zakon prikazuje se izotermama. Ovdje su to hiperbole s temperaturom T kao parametrom. Boyle-Mariotteov zakon vrijedi u potpunosti za idealni plin, dok za realne plinove pri visokim tlakovima nastaju manji otkloni.[1]
Objašnjenje[uredi | uredi kôd]
Imamo li u jednom cilindru koji je zatvoren stapom ili klipom neku količinu plina, on tlači na stijenke posude. Kako plin nastoji da se širi na što veći obujam (volumen), moramo odozgo na stap staviti uteg čiji tlak mora biti jednak unutarnjem tlaku plina. Metnemo li na stap u cilindru veći uteg, obujam plina će se smanjiti, ali će mu se povećati tlak. To znači da se tlak plina zbog smanjenja obujma toliko povećao da je u stanju držati ravnotežu vanjskom tlaku. Obratno, ako se vanjski tlak smanji, plin će se dotle raširiti, to jest povećati svoj obujam, dok stap u novom položaju ne bude opet u ravnoteži. To znači da je tlak plina zbog povećanja obujma pao i izravnao se s vanjskim smanjenim tlakom. Navedeni pokus moramo vršiti uz jednaku temperaturu. Temperaturu držimo stalno tako da cilindar stavimo u posudu kroz koju struji voda iste temperature.
Za plinove je uopće svojstveno da mala promjena vanjskog tlaka izaziva veliku promjenu obujma, dok kod krutih tijela vrlo velika promjena tlaka izaziva malu promjenu obujma. Kako se mijenja obujam plina s tlakom, ustanovili su pokusima Robert Boyle i Edme Mariotte, neovisno jedan o drugome:
Ovaj izraz predstavlja Boyle-Mariotteov zakon koji glasi:
Takve promjene u stanju plinova koje se zbivaju kod iste temperature nazivaju se izotermne promjene.
Navedeni izraz možemo napisati i na drugi način:
ili općenito:[2]
Povijest zakona[uredi | uredi kôd]
Ovaj zakon je nazvan po irskom znanstveniku i filozofu Robertu Boyleu (1627. – 1691.). Prvi put je izdan 1662. Zakon je nastao nakon suradnje s dvojicom kolega znanstvenika amatera, Richardom Towneleyem i Henryjem Powerom, koji su ga i otkrili. Ovo pravilo se nazvalo po Boyleu jer je on pokusima dokazao i u javnost iznio pravilnu teoriju svojih kolega.
Prema Robertu Guntheru i ostalim autoritetima u fizici toga doba, Robert Hooke, izumitelj primitivnoga mikroskopa, mogao je također značajno pridonijeti razvoju ovoga zakona, jer je bio napredniji matematičar od Boylea. Hooke je također pripremio vakuumske cijevi u svrhu pokusa. Francuski fizičar Edme Mariotte (1620. – 1684.) otkrio je isti zakon u približno isto vrijeme, pa se i u njegovu čast ovaj zakon ponekad zove Boyle-Mariotteov zakon. No, kako je već objašnjeno, Boyle je prvi dokazao teorijsku stranu ovoga pokusa, te je njegovo ime značajnije u ovom slučaju.
Jednadžba[uredi | uredi kôd]
Boyleov zakon određuje da je umnožak obujma i tlaka jednak konstantnom idealnom plinu, pod uvjetom da je temperatura konstantna. Matematički zapis ove jednadžbe je:
gdje:
- V - obujam plina;
- p - tlak plina;
- k - konstanta (vidi zabilješke)
Vrijednost k je izračunata iz mjerenja obujma i tlaka stalno iste količine plina. Nakon promjene u sustavu, najčešće prisilnom promjenom u obujmu cijevi koje sadrži istu količinu plina, novi obujam i novi tlak se mjere. Rezultat izračunoga umnoška novog tlaka i novog obujma bi trebali biti originalna vrijednost konstante k. Obujam V i tlak p su obrnuto proporcionalni: veći obujam znaći manji tlak, te manji obujam znači veći tlak.
U dvije jednadžbe ispod, očito je da su jednadžbe povezane jednakošću, a govore da se, uz stalno istu količinu plina i istu temperaturu mijenjaju obujam i tlak proporcionalno:
U praksi se ova jednadžba rješava na način da se iz jednadžbe ispod odredi učinak buduće promjene u drugoj jednadžbi. Na primjer:
Boyleov, Charlesov i Gay-Lussacov zakon tvore Zakon kombiniranih plinova. Ova tri zakona u kombinaciji s Avogadrovim zakonom čine zakon idealnog plina.
Zabilješke[uredi | uredi kôd]
Sve dok je temperatura konstantna i količina plina ograničena, a da su oboje uključeni u jednadžbu Boyleovog zakona, k je konstantna.
Vidi još[uredi | uredi kôd]
Izvori[uredi | uredi kôd]
- ↑ Boyle-Mariotteov zakon. Hrvatska enciklopedija. Leksikografski zavod Miroslav Krleža. 2015.
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.








