Ftalna kiselina
| Ftalna kiselina | |||||
|---|---|---|---|---|---|
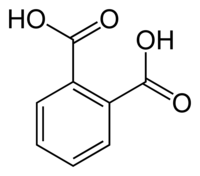 Kemijska struktura ftalne kiseline
| |||||
 | |||||
| IUPAC nomenklatura | 1,2-benzendikarboksilna kiselina | ||||
| Ostala imena | Ftalna kiselina | ||||
| Identifikacijski brojevi | |||||
| CAS broj | 88-99-3 ✓ | ||||
| EC broj | 201-873-2 ✓ | ||||
| PubChem broj | 1017 ✓ | ||||
| Osnovna svojstva | |||||
| Molarna masa | 166,132 g·mol−1 | ||||
| Izgled | Bijela krutina | ||||
| Gustoća |
1,593 g·cm−3 (20 °C) | ||||
| Talište | 207 °C[1] | ||||
| Topljivost u vodi |
U vodi 0,6 g/100 mL[2] | ||||
| Struktura | |||||
| Sigurnosne upute | |||||
| |||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | |||||
| Portal:Kemija | |||||
Ftalna kiselina (prema naftalen) ili 1,2-benzendikarboksilna kiselina, C6H4(COOH)2, je najvažnija aromatska dvobazična kiselina, s dvije skupine –COOH na susjednim ugljikovim atomima aromatskoga prstena. Dobiva se u obliku bezbojnih kristala katalitičkom oksidacijom naftalena te alkalnom hidrolizom tako nastala ftalnog anhidrida (ftalanhidrida), C8H4O3. Ftalna kiselina lako gubi vodu dajući ftalanhidrid, a u tome se obliku najčešće i upotrebljava, i to u sintezi organskih bojila (ftaleina, ftalocijanina), lijekova, plastifikatora (omekšavala) i poliesterskih smola.[3] Toksičnost ftalne kiseline je mala s LD50 (miš) od 550 mg/kg.
Ksantenska bojila[uredi | uredi kôd]

Ksantenska bojila formalno su ciklički analozi di- i trifenilmetanskih spojeva; u njima su dva aromatska prstena spojena jednim atomom kisika u orto-položaju prema metanovom ugljiku. Teorijski se izvode od heterocikličkog sistema ksantena, dibenzo-y-pirana, ali se od njega ne pripravljaju. Sam ksanten je bezbojan, no derivati s auksokromnim grupama u molekuli su obojeni. Prema supstituentima koji se nalaze u molekuli dijele se ksantenska bojila u tri podgrupe. Prva sadrži hidroksi-derivate, druga amino-derivate, a treća amino-hidroksi-derivate. Kromofor je ovih bojila u slučaju aminoderivata rezonantni hibrid oksonijskog, amonijskog i karbonijskog oblika molekule (I, II, III). Hidroksi-derivati se gubitkom protona stabiliziraju dajući električki nenabijen sistem čiji je kromofor kinonoidna struktura IV.
Ova su bojila i po svojstvima bojenja bliza arilmetanskim bojilima. Obojenja koja se njima postižu vrlo su čista i jarka. Najbrojnije su zastupana crvena i ružičasta s nekoliko žutih i ljubičastih. Neka od ovih bojila snažno fluoresciraju u otopini, pa i na obojenom materijalu. I u ovoj se grupi nalaze bojeni lakovi pripremljeni taloženjem s fosfor-volfram-molibdenskom kiselinom. Niz crvenih i narančastih bojila ove skupine važan je za bojenje kozmetičkih preparata, živežnih namirnica i ljekovitih pripravaka.
Među značajnije predstavnike ksantenskih bojila ide sulforodamin B, C.I. 45100; priprema se tako da se kondenzira benzaldehid-2,4-disulfonska kiselina s m-dietilaminofenolom, produkt dehidrira sumpornom kiselinom, oksidira željeznim kloridom i prevede u natrijevu sol. Rodamin B, C.I. 45170, jedno od prvih bojila ove grupe, dobiva se kondenzacijom anhídrida ftalne kiseline s m-dietilaminofenolom; ako se kao aminska komponenta upotrijebi 3-etilamino-p-krezol i tako nastali produkt esterificira alkoholom, nastaje rodamin 6G, C. I. 45160. Echtsáureviolett ARR, C.I. 45190, dobiva se obradom fluoresceina fosfornim trikloridom, kondenzacijom tako nastalog 3',6'-diklorfluorana s o-toluidinom i sulfuriranjem. Fluorescein, C. I. 45350, priprema se kondenzacijom anhídrida ftalne kiseline s rezorcinom. Njegove alkalne soli, poznate pod imenom uranin neobično jako fluoresciraju u otopini (i u razređenju 1 : 40 000 000), pa se stoga upotrebljavaju za označavanje i ispitivanje vodenih tokova. Bromiranjem fluoresceina priprema se tetrabromfluorescein, eozin G, C.I. 45380, a jodiranjem dijodfluorescein, Eritrozin 6G, C. I. 45425. Coerulein S, C.I. 45510, nastaje obradom Galleina (C.I. 45445) koncentriranom sumpornom kiselinom. Gallein se dobiva kondenzacijom pirogalola ili galne kiseline s anhidridom ftalne kiseline.[4]
Izvori[uredi | uredi kôd]
- ↑ Several melting points are reported, for example: (i) 480. K (NIST website), (ii) 210−211 °C with decomposition (Sigma-Aldrich on-line), (iii) 191 °C in a sealed tube (Ullmann's Encyclopedia of Industrial Chemistry), (iv) 230 °C with conversion to phthalic anhydride and water (J.T.Baker MSDS).
- ↑ PHTHALIC ACID. hazard.com
- ↑ ftalna kiselina, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2020., pristupljeno 7. 12. 2020
- ↑ "Tehnička enciklopedija" (Bojila), glavni urednik Hrvoje Požar, Grafički zavod Hrvatske, 1987.



