Dušična kiselina: razlika između inačica
m robot Dodaje: jv:Asam nitrat |
slika |
||
| Redak 56: | Redak 56: | ||
Obično se čuva u tamno smeđim bocama zbog fotolitičke razgradnje u dušikov tetroksid (N<sub>2</sub>O<sub>4</sub>). |
Obično se čuva u tamno smeđim bocama zbog fotolitičke razgradnje u dušikov tetroksid (N<sub>2</sub>O<sub>4</sub>). |
||
Dušična kiselina otapa većinu [[metal]]a čime nastaju odgovarajući [[nitrati]]. Koncentrirana dušična kiselina također reagira s nekim [[nemetali]]ma čime nastaje okso kiselina ili oksid. |
Dušična kiselina otapa većinu [[metal]]a čime nastaju odgovarajući [[nitrati]]. Koncentrirana dušična kiselina također reagira s nekim [[nemetali]]ma čime nastaje okso kiselina ili oksid. |
||
==Svojstva== |
==Svojstva== |
||
Čista bezvodna dušična kiselina (100%) na sobnoj je temperaturi bezbojna tekućina [[gustoća|gustoće]] 1,522 g/cm³ |
Čista bezvodna dušična kiselina (100%) na sobnoj je temperaturi bezbojna tekućina [[gustoća|gustoće]] 1,522 g/cm³ |
||
| Redak 69: | Redak 70: | ||
===Industrijska proizvodnja=== |
===Industrijska proizvodnja=== |
||
Dušična kiselina proizvodi se [[Ostwaldov proces|Ostwaldovim procesom]], nazvanim po njemačkom kemičaru [[Wilhelm Ostwald|Wilhelmu Ostwaldu]]. U ovom procesu bezvodni [[amonijak]] se oksidira u dušikov oksid, koji zatim reagira s [[kisik]]om iz zraka čime nastaje dušikov dioksid. On se zatim absorbira u vodi čime nastaje dušična kiselina i dušikov oksid. Dušikov oksid se zatim vraća nazad u proces. Korištenjem [[amonijak]]a dobivenog iz Haberovog procesa, konačni produkt može se proizvesti iz [[dušik]]a, [[kisik]]a i [[vodik]]a koji su dobiveni iz [[zrak]]a i prirodnog plina kao jedinih sirovina. |
Dušična kiselina proizvodi se [[Ostwaldov proces|Ostwaldovim procesom]], nazvanim po njemačkom kemičaru [[Wilhelm Ostwald|Wilhelmu Ostwaldu]]. U ovom procesu bezvodni [[amonijak]] se oksidira u dušikov oksid, koji zatim reagira s [[kisik]]om iz zraka čime nastaje dušikov dioksid. On se zatim absorbira u vodi čime nastaje dušična kiselina i dušikov oksid. Dušikov oksid se zatim vraća nazad u proces. Korištenjem [[amonijak]]a dobivenog iz Haberovog procesa, konačni produkt može se proizvesti iz [[dušik]]a, [[kisik]]a i [[vodik]]a koji su dobiveni iz [[zrak]]a i prirodnog plina kao jedinih sirovina. |
||
===Laboratorijska sinteza=== |
===Laboratorijska sinteza=== |
||
Dušična se kiselina može dobiti u laboratoriju reakcijom otprilike jednakih masa [[nitrati|nitratne]] soli (npr. bakrov(II) nitrat) i 96% sulfatne kiseline (H<sub>2</sub>SO<sub>4</sub>) i zatim destilacijom smjese na temperaturi [[vrelište|vrelišta]] dušične kiseline od 83 °C sve dok bijela kristalna masa (metalni [[sulfati|sulfat]]) ne zaostane u reakcijskoj posudi. |
Dušična se kiselina može dobiti u laboratoriju reakcijom otprilike jednakih masa [[nitrati|nitratne]] soli (npr. bakrov(II) nitrat) i 96% sulfatne kiseline (H<sub>2</sub>SO<sub>4</sub>) i zatim destilacijom smjese na temperaturi [[vrelište|vrelišta]] dušične kiseline od 83 °C sve dok bijela kristalna masa (metalni [[sulfati|sulfat]]) ne zaostane u reakcijskoj posudi. |
||
| Redak 78: | Redak 80: | ||
Najvažnija uporaba dušične kiseline je u proizvodnji umjetnih gnojiva i trenutno je u poljoprivredi najiskorištenija. Ostale važne primjene su u proizvodnji [[eksploziv]]a, graviranje i otapanje [[metal]]a (naročito kao sastavni dio [[zlatotopka|zlatotopke]] za pročiščavanje i ekstrakciju [[zlato|zlata]]), u kemijskoj sintezi, proizvodnji pića (pivovare, mljekare, proizvodnja bezalkoholnih pića), proizvodnji stakla, te služi za razna čišćenja u restaurarstvu. |
Najvažnija uporaba dušične kiseline je u proizvodnji umjetnih gnojiva i trenutno je u poljoprivredi najiskorištenija. Ostale važne primjene su u proizvodnji [[eksploziv]]a, graviranje i otapanje [[metal]]a (naročito kao sastavni dio [[zlatotopka|zlatotopke]] za pročiščavanje i ekstrakciju [[zlato|zlata]]), u kemijskoj sintezi, proizvodnji pića (pivovare, mljekare, proizvodnja bezalkoholnih pića), proizvodnji stakla, te služi za razna čišćenja u restaurarstvu. |
||
[[Slika:HNO3 Slika2.JPG|mini|150px|Veliko pakiranje 56% dušične kiseline]] |
|||
==Sigurnost== |
==Sigurnost== |
||
Dušična kiselina je snažno oksidirajuće sredstvo i njena reakcija sa spojevima kao što su cijanidi, karbidi i metalni prah može biti eksplozivna. |
Dušična kiselina je snažno oksidirajuće sredstvo i njena reakcija sa spojevima kao što su cijanidi, karbidi i metalni prah može biti eksplozivna. |
||
Inačica od 13. siječnja 2013. u 18:50
| Dušična kiselina | |
| |
| Oznake | |
| CAS broj | 7697-37-2 |
| EC broj | 231-714-2 |
| Svojstva | |
| Sistemsko ime | Dušična kiselina |
| Druga imena | Nitratna kiselina |
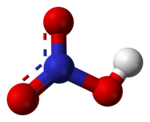
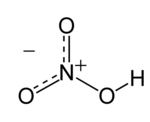
| Kemijska formula | HNO3 |
| Molarna masa | 63,012 g/mol |
| Izgled | Bistra, bezbojna tekućina |
| Gustoća i faza | 1,5129 g/L, plin |
| Topljivost u vodi | Mogu se miješati u svim omjerima |
| Talište | -42°C (231 K) |
| Vrelište | 83 °C (356 K) |
| Kiselost (pKa) | -1,4 |
| Dipolni moment | 2,17 D |
| Glavne opasnosti | Oksidans, korozivna. |

Dušična ili nitratna kiselina (kemijska formula HNO3) je izrazito korozivna i toksična jaka kiselina.
Koncentrirana dušična kiselina je jako oksidirajuće sredstvo.
U čistom stanju je bezbojna, ali sa starenjem postaje žućkasta zbog akumuliranja dušikovih oksida.
Obično se čuva u tamno smeđim bocama zbog fotolitičke razgradnje u dušikov tetroksid (N2O4).
Dušična kiselina otapa većinu metala čime nastaju odgovarajući nitrati. Koncentrirana dušična kiselina također reagira s nekim nemetalima čime nastaje okso kiselina ili oksid.
Svojstva
Čista bezvodna dušična kiselina (100%) na sobnoj je temperaturi bezbojna tekućina gustoće 1,522 g/cm³ koja se skrućuje pri -42 °C tvoreći bijele kristale. Temperatura vrelišta je 83 °C. U prisutnosti svjetlosti, čak i pri sobnoj temperaturi, dolazi do djelomične razgradnje uz nastajanje dušikovog dioksida prema reakciji:
- 4 HNO3 → 2 H2O + 4 NO2 + O2 (72°C)
- 4 HNO3 → 2 H2O + 4 NO2 + O2 (72°C)
što znači da bi bezvodna dušična kiselina trebala biti uskladištena ispod 0°C da bi se izbjegla razgradnja. Dušikov dioksid (NO2) ostaje otopljen u dušičnoj kiselini i daje joj žutu boju. Za razliku od čiste kiseline iz koje izlaze bijele pare, kiselina s otopljenim NO2 ispušta crvenkasto-smeđe pare, zbog čega se često navodi kao "crvena dimeća kiselina" ili "dimeća dušična kiselina". Dimeća dušična kiselina se također navodi kao 16-molarna dušična kiselina, najkoncentriraniji oblik dušične kiseline pri standardnoj temperaturi i tlaku (0 °C, 100 kPa).
Dobivanje

Industrijska proizvodnja
Dušična kiselina proizvodi se Ostwaldovim procesom, nazvanim po njemačkom kemičaru Wilhelmu Ostwaldu. U ovom procesu bezvodni amonijak se oksidira u dušikov oksid, koji zatim reagira s kisikom iz zraka čime nastaje dušikov dioksid. On se zatim absorbira u vodi čime nastaje dušična kiselina i dušikov oksid. Dušikov oksid se zatim vraća nazad u proces. Korištenjem amonijaka dobivenog iz Haberovog procesa, konačni produkt može se proizvesti iz dušika, kisika i vodika koji su dobiveni iz zraka i prirodnog plina kao jedinih sirovina.
Laboratorijska sinteza
Dušična se kiselina može dobiti u laboratoriju reakcijom otprilike jednakih masa nitratne soli (npr. bakrov(II) nitrat) i 96% sulfatne kiseline (H2SO4) i zatim destilacijom smjese na temperaturi vrelišta dušične kiseline od 83 °C sve dok bijela kristalna masa (metalni sulfat) ne zaostane u reakcijskoj posudi.
- H2SO4 + NO3- → HSO4- (s) + HNO3 (g)
Dobivena crvena dimeća dušićna kiselina može se zatim prevesti u bijelu dušičnu kiselinu.
Uporaba
Najvažnija uporaba dušične kiseline je u proizvodnji umjetnih gnojiva i trenutno je u poljoprivredi najiskorištenija. Ostale važne primjene su u proizvodnji eksploziva, graviranje i otapanje metala (naročito kao sastavni dio zlatotopke za pročiščavanje i ekstrakciju zlata), u kemijskoj sintezi, proizvodnji pića (pivovare, mljekare, proizvodnja bezalkoholnih pića), proizvodnji stakla, te služi za razna čišćenja u restaurarstvu.

Sigurnost
Dušična kiselina je snažno oksidirajuće sredstvo i njena reakcija sa spojevima kao što su cijanidi, karbidi i metalni prah može biti eksplozivna.
