Trinitrotoluen
| Trinitrotoluen C7H5N3O6, 2,4,6-trinitrotoluen | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Krutina TNT-a
| ||||||||||||||
| IUPAC nomenklatura | 2-metil-1,3,5-trinitrobenzen | |||||||||||||
| Ostala imena | 2,4,6-trinitrotoluen TNT Trilit Tolit Trinol Trotil Tritol Tritolol Triton Trotol Trinitrotoluol 2,4,6-trinitrometilbenzen | |||||||||||||
| Identifikacijski brojevi | ||||||||||||||
| CAS broj | 118-96-7 ✓ | |||||||||||||
| UN broj | 0209 (suh ili <30% vode) 0388, 0389 (pomiješan sa trinitrobenzenom, heksanitrostilbenom) ? | |||||||||||||
| RTECS broj | XU0175000 ✓ | |||||||||||||
| EC broj | 204-289-6 ✓ | |||||||||||||
| PubChem broj | 8376 ✓ | |||||||||||||
| Osnovna svojstva | ||||||||||||||
| Molarna masa | 227.13 g·mol−1 | |||||||||||||
| Izgled | Blijedožuta krutina | |||||||||||||
| Gustoća |
1.654 g·cm−3 | |||||||||||||
| Talište | 353.50 K 80.35 °C | |||||||||||||
| Vrelište | 513.1 K (raspada se) 240.0 °C | |||||||||||||
| Tlak para |
0.0002 mmHg (20 °C)[1] | |||||||||||||
| Struktura | ||||||||||||||
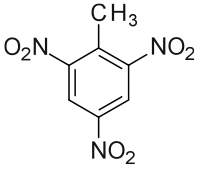 | ||||||||||||||
| Sigurnosne upute | ||||||||||||||
| ||||||||||||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | ||||||||||||||
| Portal:Kemija | ||||||||||||||
Trinitrotoluen (C7H5N3O6, 2,4,6-trinitrotoluen, TNT, trotil) je nitrospoj toluena, te najviše primijenjeni vojni eksploziv. To je blijedo-žuta kristalna tvar. Na suncu potamni u narančastu boju. Može se dugo čuvati, a ne mijenja osobine. Malo je osjetljiv na udar, pa se njime lako rukuje. Pripada u srednje jake brizantne eksplozive. Zapaljen plamenom na otvorenom prostoru sagorijeva mirnim crveno-žutim plamenom. Upotrebljava se liven i prešan, čist ili u smjesi s drugim eksplozivima, kao što su pentrit, heksogen, tetril (tetratol) i amonijev nitrat. Za miniranje i rušenje trotil se preša ili lije u razne oblike koji se nazivaju „trotilski metak“. U obliku valjka od 75g i 100g, 100g i 200g u obliku pravokutnika, 500g, te od 25kg u drvenoj kutiji.
Svojstva[uredi | uredi kôd]
Čisti spoj je svijetložute boje, otrovan, zapaljiv i eksplozivan. Lako se i sigurno tali i lijeva, zbog čega se ubrzo nakon otkrića počeo koristiti kao punjenje bombi.
Relativna moć: 100% TNT.
Energija eksplozije: 4,23 kJg-1
Volumen plinova: 710 cm3g-1
Detonacijska brzina: 6900 ms-1
Povijest[uredi | uredi kôd]
Prvi ga je sintetizirao njemački kemičar Joseph Wilbrand 1863. godine, te se prvih nekoliko godina koristio kao žuto bojilo, zbog svoje slabe osjetljivosti na mehanički stres. 1902. godine prihvaćen je kao korisni eksploziv.
Proizvodnja[uredi | uredi kôd]
Dobiva se trostupanjskom nitracijom.
Toluen ili metilbenzen se nitrira smjesom koncentrirane sumporne i dušične kiseline u nitrotoluen, koji se odvaja i ponovno nitrira u dinitrotoluen. U zadnjem koraku, dinitrotoluen se nitrira dušičnom kiselinom u oleumu.
Nakon sinteze, stabilizira se otopinom natrijevog sulfita, koji reducira nestabilne izomere spoja i ostatke reaktanata. Dobivena otpadna otopina crvene je boje i značajan je onečišćivač.
Prilikom nitracija važna je kontrola dušikovih oksida u reakcijskoj smjesi, jer može doći do egzotermne reakcije u kojoj oksidiraju metilnu grupu na toluenskom prstenu, te eksplozije.
Opasnost[uredi | uredi kôd]
Osim eksplozivnosti pri visokim temperaturama, spoj je otrovan, negativno utječe na plodnost muškarca i sumnja se da je kancerogen.
Izvori[uredi | uredi kôd]
- ↑ NIOSH Pocket Guide to Chemical Hazards #0641. National Institute for Occupational Safety and Health (NIOSH)





