Benzen: razlika između inačica
Nema sažetka uređivanja |
Nema sažetka uređivanja |
||
| Redak 60: | Redak 60: | ||
== Dobivanje == |
== Dobivanje == |
||
*[[Frakcijska destilacija|Frakcijskom destilacijom]] katrana kamenog ugljena |
*[[Frakcijska destilacija|Frakcijskom destilacijom]] katrana kamenog [[Ugljen|ugljena]] |
||
*[[Sinteza (kemija)|Sintezom]] tri molekule [[etin]]a (C<sub>2</sub>H<sub>2</sub>) |
*[[Sinteza (kemija)|Sintezom]] tri molekule [[etin]]a (C<sub>2</sub>H<sub>2</sub>) |
||
3 HC≡CH → C<sub>6</sub>H<sub>6</sub> |
3 HC≡CH → C<sub>6</sub>H<sub>6</sub> |
||
| Redak 67: | Redak 67: | ||
== Svojstva == |
== Svojstva == |
||
Benzen je pri sobnoj temperaturi bezbojna [[tekućina]], jakog mirisa. [[Vrelište|Vrije]] pri 80.1 [[°C]], dok pri temperaturi nižoj od 5.5°C skrućuje se u bijelu [[kristal|kristalnu]] tvar. U [[voda|vodi]] se |
Benzen je pri sobnoj temperaturi bezbojna [[tekućina]], jakog mirisa. [[Vrelište|Vrije]] pri 80.1 [[°C]], dok pri temperaturi nižoj od 5.5°C skrućuje se u bijelu [[kristal|kristalnu]] tvar. U [[voda|vodi]] se ne [[topljivost|otapa]], ali se vrlo dobro otapa u organskim [[otapalo|otapalima]]. Benzen je također dobro organsko otaplao, otapa [[masti i ulja]], [[smole]] i [[boje]].Benzenove pare su vrlo otrovne i uzrokuju kancerogena oboljenja, najčešće [[leukemija|leukemiju]]. Derivati benzena nisu otrovni kao benzen pa se koriste kao zamjena za benzen u industriji. Lako je zapaljiv, zapaljen gori karakterističnim čađavim plamenom. |
||
:2C<sub>6</sub>H<sub>6</sub> + 15O<sub>2</sub> → 12CO<sub>2</sub> + 6H<sub>2</sub>O |
:2C<sub>6</sub>H<sub>6</sub> + 15O<sub>2</sub> → 12CO<sub>2</sub> + 6H<sub>2</sub>O |
||
| Redak 75: | Redak 75: | ||
'''Supstitucija:''' |
'''Supstitucija:''' |
||
[[Halogeniranje]]: Halogeni element(X - Cl,Br) reagira sa benzenom, pri čemu nastaje odgovarajući derivat benzena i odgovarajući halogenovodik. Dobivanje brombenzena: |
[[Halogeniranje]]: [[Halogeni elementi|Halogeni element]](X - Cl,Br) reagira sa benzenom, pri čemu nastaje odgovarajući derivat benzena i odgovarajući halogenovodik. Dobivanje brombenzena: |
||
:C<sub>6</sub>H<sub>6</sub> + Br<sub>2</sub> → C<sub>6</sub>H<sub>5</sub>Br + HBr |
:C<sub>6</sub>H<sub>6</sub> + Br<sub>2</sub> → C<sub>6</sub>H<sub>5</sub>Br + HBr |
||
Nitriranje: Smjesa koncentrirane dušične i sumporne kiseline reagira sa benzenom pri čemu nastaje nitrobenzen i voda. Dobivanje nitrobenzena: |
[[Nitriranje]]: Smjesa koncentrirane [[Dušična kiselina|dušične]] i [[Sumporna kiselina|sumporne]] [[kiseline]] reagira sa benzenom pri čemu nastaje nitrobenzen i voda. Dobivanje nitrobenzena: |
||
:C<sub>6</sub>H<sub>6</sub> + HNO<sub>2</sub> (uz conc. H<sub>2</sub>SO<sub>4</sub> kao katalizator) → :C<sub>6</sub>H<sub>5</sub>NO<sub>2</sub> + H<sub>2</sub>O |
:C<sub>6</sub>H<sub>6</sub> + HNO<sub>2</sub> (uz conc. H<sub>2</sub>SO<sub>4</sub> kao katalizator) → :C<sub>6</sub>H<sub>5</sub>NO<sub>2</sub> + H<sub>2</sub>O |
||
Sulfoniranje: Otopina sumporova(VI) oksida u sumpornoj kiselini, poznata kao oleum ili dimeća sumporna kiselina reagira sa benzenom pri čemu nastaje benzensulfonska kiselina. Njezine soli se nazivaju benzensulfonati. Kemijska jednadžba sulfoniranja benzena: |
Sulfoniranje: Otopina sumporova(VI) oksida u [[Sumporna kiselina|sumpornoj kiselini]], poznata kao oleum ili dimeća sumporna kiselina reagira sa benzenom pri čemu nastaje benzensulfonska kiselina. Njezine [[soli]] se nazivaju benzensulfonati. Kemijska jednadžba sulfoniranja benzena: |
||
:C<sub>6</sub>H<sub>6</sub> + SO<sub>3</sub> (uz conc. H<sub>2</sub>SO<sub>4</sub> kao katalizator) → :C<sub>6</sub>H<sub>5</sub>SO<sub>3</sub>H |
:C<sub>6</sub>H<sub>6</sub> + SO<sub>3</sub> (uz conc. H<sub>2</sub>SO<sub>4</sub> kao katalizator) → :C<sub>6</sub>H<sub>5</sub>SO<sub>3</sub>H |
||
Alkiliranje: Reakcijom halogenalkana(R-X) s benzenom uz AlX<sub>3</sub> kao katalizator, nastaje alkalirani benzen i halogenovodik. Kemijska jednadžba reakcije dobivanja etilbenzena: |
Alkiliranje: Reakcijom halogenalkana(R-X) s benzenom uz AlX<sub>3</sub> kao [[katalizator]], nastaje alkalirani benzen i halogenovodik. Kemijska jednadžba reakcije dobivanja etilbenzena: |
||
:C<sub>6</sub>H<sub>6</sub> + CH<sub>3</sub>CH<sub>2</sub>Cl (uz conc. AlCl<sub>3</sub> kao katalizator) → :C<sub>6</sub>H<sub>5</sub>CH<sub>2</sub>CH<sub>3</sub> + HCl |
:C<sub>6</sub>H<sub>6</sub> + CH<sub>3</sub>CH<sub>2</sub>Cl (uz conc. AlCl<sub>3</sub> kao katalizator) → :C<sub>6</sub>H<sub>5</sub>CH<sub>2</sub>CH<sub>3</sub> + HCl |
||
| Redak 92: | Redak 92: | ||
'''Adicija:''' |
'''Adicija:''' |
||
Katalitičko hidrogeniranje benzena: Reakcija benzena i vodika uz nikal kao katalizator uz visoku temperaturu i tlak. Produkt |
Katalitičko hidrogeniranje benzena: Reakcija benzena i [[Vodik|vodika]] uz [[nikal]] kao [[katalizator]] uz visoku [[temperatura|temperaturu]] i [[tlak]]. Produkt kemijske reakcije je cikloheksan. |
||
:C<sub>6</sub>H<sub>6</sub> + 3H<sub>2</sub> (uz nikal, pri 400 °C i 40 bara, kao katalizator) → C<sub>6</sub>H<sub>12</sub> |
:C<sub>6</sub>H<sub>6</sub> + 3H<sub>2</sub> (uz nikal, pri 400 °C i 40 bara, kao katalizator) → C<sub>6</sub>H<sub>12</sub> |
||
Inačica od 21. srpnja 2011. u 18:40
| Benzen | |
| |
| Oznake | |
| CAS broj | 71-43-2 |
| Svojstva | |
| Sistemsko ime | Benzen |
| Druga imena | Benzol, cikloheks-1,3,5-trien |
| Kemijska formula | C6H6 |
| Molarna masa | 78.11 g/mol |
| Izgled | Bistra, bezbojna tekućina |
| Gustoća i faza | 0.8765 g/L, tekućina |
| Topljivost u vodi | 1.8 g/L (15 °C) |
| Talište | 5.5 °C(278,7K) |
| Vrelište | 80.1 °C(353,3 K) |
| Viskoznost | 0.652 cP (pri 20 °C) |
| Dipolni moment | 0 D |
| Temperatura paljenja | -11 °C |
| Glavne opasnosti | |

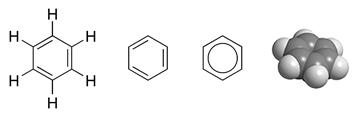
Benzen je najjednostavniji aromatski ugljikovodik. Empirijska formula mu je C6H6. [1] Prvi ga je izdvojio Michael Faraday 1825. godine suhom destilacijom kamenog ugljena. Iz brojevnog se omjera atoma ugljika i vodika može zaključiti da je benzen nezasićeni ugljikovodik, ali se pokazalo da po kemijskim svojstvima razlikuje od do sada proučavanih nezasićenih ugljikovodika. Znanstvenici su dugo pokušavali odrediti strukturnu formulu. Njemački kemičar Friedrich August Kekulé von Stradonitz to je postigao tako da je naizmjenice postavio jednostruke i dvostruke veze između atoma ugljika.
Može se crtati i s jednostrukom vezom između atoma ugljika i kružnicom unutar šesterokuta što se naziva benzenov prsten. Svi aromatski ugljikovodici imaju jedan ili više benzenovih prstenova.
Dobivanje
- Frakcijskom destilacijom katrana kamenog ugljena
- Sintezom tri molekule etina (C2H2)
3 HC≡CH → C6H6
- Dekarboksilacijom benzojeve kiseline
Svojstva
Benzen je pri sobnoj temperaturi bezbojna tekućina, jakog mirisa. Vrije pri 80.1 °C, dok pri temperaturi nižoj od 5.5°C skrućuje se u bijelu kristalnu tvar. U vodi se ne otapa, ali se vrlo dobro otapa u organskim otapalima. Benzen je također dobro organsko otaplao, otapa masti i ulja, smole i boje.Benzenove pare su vrlo otrovne i uzrokuju kancerogena oboljenja, najčešće leukemiju. Derivati benzena nisu otrovni kao benzen pa se koriste kao zamjena za benzen u industriji. Lako je zapaljiv, zapaljen gori karakterističnim čađavim plamenom.
- 2C6H6 + 15O2 → 12CO2 + 6H2O
Zbog postojanja jednostrukih i dvostrukih veza stupa u reakcije adicije i supstitucije.
Supstitucija:
Halogeniranje: Halogeni element(X - Cl,Br) reagira sa benzenom, pri čemu nastaje odgovarajući derivat benzena i odgovarajući halogenovodik. Dobivanje brombenzena:
- C6H6 + Br2 → C6H5Br + HBr
Nitriranje: Smjesa koncentrirane dušične i sumporne kiseline reagira sa benzenom pri čemu nastaje nitrobenzen i voda. Dobivanje nitrobenzena:
- C6H6 + HNO2 (uz conc. H2SO4 kao katalizator) → :C6H5NO2 + H2O
Sulfoniranje: Otopina sumporova(VI) oksida u sumpornoj kiselini, poznata kao oleum ili dimeća sumporna kiselina reagira sa benzenom pri čemu nastaje benzensulfonska kiselina. Njezine soli se nazivaju benzensulfonati. Kemijska jednadžba sulfoniranja benzena:
- C6H6 + SO3 (uz conc. H2SO4 kao katalizator) → :C6H5SO3H
Alkiliranje: Reakcijom halogenalkana(R-X) s benzenom uz AlX3 kao katalizator, nastaje alkalirani benzen i halogenovodik. Kemijska jednadžba reakcije dobivanja etilbenzena:
- C6H6 + CH3CH2Cl (uz conc. AlCl3 kao katalizator) → :C6H5CH2CH3 + HCl
Adicija:
Katalitičko hidrogeniranje benzena: Reakcija benzena i vodika uz nikal kao katalizator uz visoku temperaturu i tlak. Produkt kemijske reakcije je cikloheksan.
- C6H6 + 3H2 (uz nikal, pri 400 °C i 40 bara, kao katalizator) → C6H12
Kloriranje benzena: Mehanizam kloriranja benzena apsorbira UV zračenje, to znači da UV zračenje djeluje kao katalizator na reakciju. Produkt reakcije je 1,2,3,4,5,6-heksaklorcikloheksan.
- C6H6 + 3Cl2 (hv)→ C6H6Cl6
Upotreba
Koristi se kao otapalo, zatim za proizvodnju lijekova, boja, lakova, plastičnih masa, eksploziva, sredstava za pranje , insekticida. Benzen se sve više izbjegava u industriji jer je otrovan i izaziva kancerogena oboljenja. Upravo zbog njegovog štetnog djelovanja, u industriji ga zamjenjuju njegovi derivati koji nisu toliko štetni za ljudsko zdravlje, npr. toluen.
Izvori
- ↑ Tehnička enciklopedija Leksikografskog zavoda Miroslav Krleža, Zagreb, svezak 1, str. 418
Predložak:Link FA
Predložak:Link FA
Predložak:Link FA
Predložak:Link FA
