Termodinamika








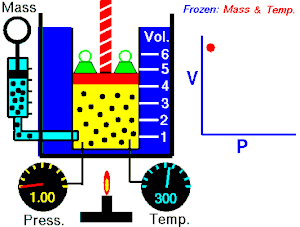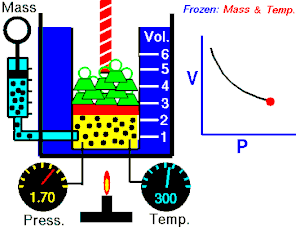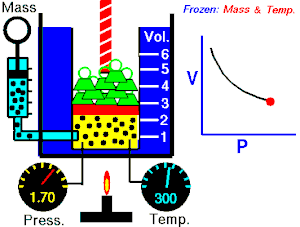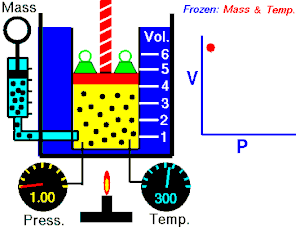

Termodinamika ili znanost o toplini je grana fizike koja proučava izmjenu topline i mehaničkoga rada između sustava i okoline, te druge zakonitosti pretvorbe i prijenosa energije, posebno u plinovima. Osnivačem moderne termodinamike smatra se N. L. S. Carnot, koji je u svojem eseju Razmišljanja o pokretačkoj moći vatre (fran. Réflexions sur la puissance motrice du feu, 1824.) dao načela rada idealnoga toplinskoga stroja. Eksperimentalne osnove termodinamike postavio je J. P. Joule u nizu pokusa (od 1840. do 1843.), koji su nedvojbeno dokazali da se prijelaz rada u toplinu odvija uvijek po istim kvantitativnim zakonima.
Mnoge pojave, pa i sami termodinamički zakoni, koji su izvedeni na temelju iskustvenih podataka, objašnjeni su tek upotrebom metoda statističke fizike (Ludwig Boltzmann). Odstupanje rezultata klasične statističke fizike od rezultata pokusa dovelo je do razvoja kvantne mehanike.[1]
Termodinamika proučava energiju, rad, toplinu, entropiju, entalpiju i spontanost procesa (Gibbsovu energiju). Termodinamika proučava veze između toplinske energije i ostalih oblika energije koje se u tvarima izmjenjuju u uvjetima ravnoteže. Naime, gotovo svaki oblik energije u svojoj pretvorbi prelazi na kraju u energiju toplinskog kretanja. Tako na primjer trenje, električna energija, energija kemijske reakcije, svjetlosna energija i druge pretvorbama prelaze u toplinu.
Pojam topline i temperature[uredi | uredi kôd]
Ako stavimo ruku u posudu s vrućom vodom i držimo je nekoliko sekundi, a zatim je stavimo u posudu s toplom vodom, učinit će nam se kao da je ta voda hladna. Stavimo li ruku u hladnu vodu i držimo li je nekoliko sekundi, a onda je uronimo u onu toplu vodu, imat ćemo osjet kao da smo je stavili u vruću vodu. Odatle vidimo da čovječji osjet nije mjerodavan za prosuđivanje stanja nekoga fizikalnog tijela, to jest njegove temperature.
Toplina i temperatura nisu jedno te isto. To najbolje možemo uočiti iz jednog primjera. U dvije po veličini različite prostorije ložimo peć iste veličine tako da trošimo istu količinu goriva na sat; vidjet ćemo da će temperature prostorija biti različite. Veća prostorija imat će manju temperaturu, a manja veću, iako je svaka prostorija, to jest zrak u prostoriji, primio istu količinu topline izgaranjem jednake količine goriva. Dva fizikalna tijela mogu imati istu količinu topline, a različitu temperaturu. Da bi veća prostorija imala istu temperaturu kao manja, morali bismo većoj dati veću količinu topline, to jest morali bismo potrošiti veću količinu goriva. Odatle vidimo da dva fizikalna tijela mogu imati istu temperaturu, ali različitu količinu topline.
Na pitanje što je toplina odgovara molekularno-kinetička teorija topline. Molekule u tijelima ne miruju, nego se nalaze u stalnom gibanju, čija brzina može biti veća ili manja. Bušenjem, glodanjem, tokarenjem i rezanjem pomoću alatnih strojeva, kao i kod svake obrade materijala alatom, stvara se toplina. Toplina nastaje na osnovu utrošenog mehaničkog rada, a i na račun kinetičke energije. Udarom čekića, koji ima kinetičku energiju, o nakovanj stvara se toplina. Tu se kinetička energija ne pretvara samo u toplinu nego i u energiju zvuka i u mehanički rad potreban za deformaciju tijela. Pri sudaru dvaju tijela prenosi se gibanje, to jest kinetička energija s jednog tijela na drugo. To ne vrijedi samo za velika tijela nego i za sitne čestice, to jest molekule. Kinetička energija čekića pretvara se u kinetičku energiju molekula, to jest u njihovo nevidljivo gibanje. Toplina je, dakle, kinetička energija molekularnog gibanja.
Što tijelo više grijemo, molekule se sve brže gibaju i imaju sve veću kinetičku energiju. Zbog toga se molekule međusobno udaljavaju, pa kruto tijelo taljenjem prelazi u tekuće agregatno stanje. Tekuće tijelo zagrijavanjem prelazi u plinovito agregatno stanje. Molekule vode daljim zagrijavanjem kod vrelišta odlaze u zrak. Voda prelazi u vodenu paru. Para ima toliku kinetičku energiju da tjera parni stroj. Koliki je stupanj toga molekularnog gibanja, kazuje temperatura. Temperatura je, dakle, stupanj toplinskog stanja tijela i o njoj ovisi agregatno stanje tijela.
Onaj dio nauke o toplini koji se bavi toplinom kao jednim oblikom energije i proučava pretvaranje toplinske energije u mehaničku radnju zove se termodinamika. Budući da je to pretvaranje naročito važno kod plinova, to se termodinamika bavi u prvom redu toplinskim promjenama kod plinova.[2]
Zakoni termodinamike[uredi | uredi kôd]
Nulti zakon termodinamike (definicija temperature)[uredi | uredi kôd]
Nulti zakon termodinamike određuje (definira) temperaturu kao funkciju stanja sustava. Ako su dva sustava u ravnoteži s trećim, onda su i međusobno u ravnoteži. Temperatura sustava koji nije u ravnoteži nije određena. Na temelju 1. i 2. zakona termodinamike može se odrediti je li temperatura viša ili niža, ali joj je vrijednost moguće odrediti samo usporedbom u ravnotežnom stanju. Taj zakon izriče i uvjet ravnoteže dvaju sustava: u ravnoteži njihove su temperature jednake bez obzira na ukupnu količinu unutarnje energije (topline) u svakome od njih.
Prvi zakon termodinamike – zakon o očuvanju energije[uredi | uredi kôd]
Prvi zakon termodinamike izveo je H. L. F. von Helmholtz (1847.) na temelju Jouleovih i Carnotovih radova. Prema tom je zakonu zbroj količina topline i mehaničkoga rada u zatvorenom sustavu stalan:
količina topline dQ predana nekomu sustavu troši se samo na povećanje njegove unutarnje energije U (zagrijavanje) i na svladavanje vanjskoga tlaka p, a tlak se protivi povećanju obujma (volumena) sustava V. Prvi zakon termodinamike može se poopćiti u zakon očuvanja energije, prema kojem je u svakom zatvorenom sustavu zbroj svih oblika energije, uključujući i materiju, stalan. Drugim riječima to se može iskazati kao:
"Energija zatvorenog sustava ne može nestati niti ni iz čega nastati, energija može samo prelaziti iz jednog oblika u drugi, i ona je konstantna."
Drugi zakon termodinamike[uredi | uredi kôd]
Drugi zakon termodinamike upućuje na smjer u kojem se odvija pretvorba toplinske energije u mehaničku. Do toga je zakona došao već Carnot 1824. On je proučavao idealne uvjete prelaska topline u rad i zaključio da su za prelazak topline u rad potrebna dva spremnika topline na različitoj temperaturi; prelaskom topline iz toplijega spremnika u hladniji samo se dio topline pretvara u rad, a ostatak topline prelazi u spremnik niže temperature (degradacija). Prema Carnotu, maksimalna djelotvornost η idealnoga toplinskoga stroja, koji kružnim procesom pretvara toplinu u rad, iznosi:
gdje su: T1 i T2 temperature toplijega i hladnijega spremnika; Q1 je toplina koja pri prelasku stoji na raspolaganju, a Q2 dio topline koji se degradira. Bit je drugoga zakona termodinamike da se pri prelasku topline u rad dio topline uvijek gubi ili degradira (degradacija). Matematički izraz drugoga zakona termodinamike iskazuje se s pomoću entropije. Za sustav temperature T, u kojem se nalazi ukupna količina topline Q, entropija S izražava se kao:
Iz toga slijedi da je entropija sustava to veća što mu je, uz danu količinu topline u sustavu, temperatura niža. Kako se pri svakom prelasku topline u rad dio topline prelazi u spremnik niže temperature, ukupna se entropija sustava povećava. Poopćenjem drugoga zakona može se reći da se entropija zatvorenoga sustava povećava pri svakom procesu.
Prva dva zakona termodinamike mogu se formulirati i kao nemogućnost perpetuuma mobile 1. i 2. vrste: perpetuum mobile 1. vrste bio bi stroj koji bi radio bez ulaganja energije, a perpetuum mobile 2. vrste bio bi stroj koji bi toplinu iz jednoga spremnika izravno i bez posrednika pretvarao u rad. Neostvarivost perpetuuma mobile obiju vrsta eksperimentalni je dokaz za prvi i drugi zakon termodinamike.
Treći zakon termodinamike[uredi | uredi kôd]
Treći zakon termodinamike postavka je prema kojoj je entropija sustava pri apsolutnoj nuli temperature jednaka nuli, ako se sustav nalazi u svojem najnižem energetskom stanju. Taj zakon, što ga je postavio W. H. Nernst, nije strogo termodinamičko načelo, jer pretpostavlja poznavanje detaljne strukture sustava, osobito spektra energetskih stanja. Načelo se na primjer primjenjuje u fizikalnoj kemiji pri računanju konstantâ ravnoteža sustava dobivenih iz čisto toplinskih mjerenja, a uveden je kao ishodište ljestvice za određivanje entropije. Tek s razvojem statističke fizike i određivanjem entropije kao negativnoga logaritma vjerojatnosti stanja načelo postaje nužno.
Osnovni pojmovi[uredi | uredi kôd]
Termodinamički sustav[uredi | uredi kôd]
Termodinamički sustav je fizikalni sustav u kojem nastaju međusobne pretvorbe topline i drugih oblika energije, te time izazvane promjene ovisne o promjenama temperature. Teorijski se razlikuju:
- izolirani termodinamički sustav, u kojem zatvorena tvar nema mogućnost izmjene ni tvari ni energije s okolinom,
- zatvoreni termodinamički sustav, u kojem je moguća samo izmjena energije s okolinom, pa s time i promjene volumena, tlaka i temperature, ali je količina tvari nepromjenljiva, te
- otvoreni termodinamički sustav, u kojem je moguća izmjena tvari i energije s okolinom.
U praksi ne postoje u potpunosti prva dva tipa sustava nego se oni opisuju većim ili manjim približenjem (aproksimacijom). Tako se stanje u parnom kotlu može opisati kao zatvoreni sustav ako je dotok topline jednak gubitcima, pa unutar kotla postoji stalna temperatura, tlak i količina pare. Zakonitostima promjena unutar termodinamičkoga sustava bavi se termodinamika.[3]
Termodinamički proces[uredi | uredi kôd]
Termodinamički proces je proces promjene stanja nekog termodinamičkog sustava opisan s pomoću makroskopskih veličina (temperatura, tlak, toplina, volumen), na primjer adijabatski proces, izoprocesi (izotermni, izobarni, izohorni, izentropni).
Termodinamički se reverzibilni proces (povratni proces) zbiva kada termodinamički sustav od početnoga do konačnoga stanja sporo prolazi kroz više ravnotežnih stanja, a može se odvijati i u suprotnom smjeru. Termodinamički ireverzibilni proces (nepovratni proces) zbiva se kada termodinamički sustav od početnoga do konačnoga stanja brzo prolazi kroz više neravnotežnih stanja i ne može se odvijati u suprotnom smjeru. Rad termodinamičkoga sustava ovisi o vrsti termodinamičkoga procesa kojim je sustav iz početnoga došao u konačno stanje.
Kružni termodinamički proces je proces kojim se termodinamički sustav nakon više stanja dovodi u početno stanje, na primjer Carnotov kružni proces (dva izotermna i dva adijabatska procesa), Dieselov kružni proces (izobarni, izentropni, izohoni i izentropni proces).[4]
Izoprocesi[uredi | uredi kôd]
Izoprocesi su termodinamički procesi u kojima se količina tvari i jedna od veličina stanja sustava ne mijenjaju:
- izobarni proces (izobare) zbiva se pri stalnome tlaku, dok se volumen mijenja razmjerno s temperaturom;
- izohorni proces (izohore) zbiva se pri stalnom volumenu, dok se tlak mijenja razmjerno s temperaturom;
- izotermni proces (izoterma) zbiva se pri stalnoj temperaturi, dok se tlak mijenja obrnuto razmjerno s volumenom (na primjer Boyle-Mariotteov zakon);
- izentropni proces zbiva se pri stalnoj entropiji, na primjer adijabatski proces.[5]
Stacionarno stanje[uredi | uredi kôd]
Stacionarno stanje je stanje sustava pri kojem se njegovi makroskopski čimbenici (parametri) ne mijenjaju ili u koje se sustav periodički vraća. Iz stacionarnoga stanja sustav može pokrenuti samo djelovanje vanjske sile. Moderna fizika (kvantna mehanika) proširila je pojam stacionarnoga stanja u tom smislu da stacionarno stanje ne mora biti najniže energetsko stanje čestice, nego se čestica može nalaziti konačno mnogo vremena samo u određenim stacionarnim stanjima, pravilno raspoređenima po energiji. Prijelaz između dvaju stacionarnih stanja moguć je samo uz emisiju, odnosno apsorpciju energije.[6]
Kemijska termodinamika[uredi | uredi kôd]
Kemijska termodinamika je grana termodinamike koja se bavi energijskim pretvorbama (transformacijama) tijekom kemijskih reakcija. Njezin je primarni cilj da na temelju energijskih promjena odredi uvjete koji određuju smjer spontane kemijske reakcije i njezin doseg, jer pretvorba (konverzija) reaktanata u produkte najčešće nije potpuna, pa kemijske reakcije napreduju samo do kemijske ravnoteže, to jest do stupnja u kojem se omjer koncentracija reaktanata i produkata više ne mijenja. Da bi se opisalo stanje sustava, promjene stanja i uvjeti pri kojima proces nastaje, primjenjuju se zakoni termodinamike. Promjena unutarnje energije sustava funkcija je topline i rada. U sustavu u kojem nastaje neka promjena, a volumen se sustava pritom ne mijenja, nastala toplina jednaka je promjeni unutarnje energije, dok se toplina nastala u sustavu tijekom promjene pri konstantnom tlaku određuje kao promjena entalpije, a jednaka je razlici entalpije konačnog i početnoga stanja. Sve spontane promjene u izoliranom sustavu dovode do porasta entropije sustava, koju je također moguće izračunati kao razliku entropije konačnog i početnoga stanja.[7]
Izvori[uredi | uredi kôd]
- ↑ termodinamika, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2016.
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ↑ termodinamički sustav, [2] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2016.
- ↑ termodinamički proces, [3] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2016.
- ↑ izoprocesi, [4] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2016.
- ↑ stacionarno stanje, [5] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2016.
- ↑ termodinamika, kemijska, [6] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2016.
Vanjske poveznice[uredi | uredi kôd]
- Web courseware Povijest fizike Arhivirana inačica izvorne stranice od 2. kolovoza 2012. (Wayback Machine)



