Piroliza
Piroliza je toplinska razgradnja organskog materijala pri povišenoj temperaturi i odsustvu kisika (ili bilo kojeg halogenog elementa). To uključuje istodobnu promjenu kemijskog sastava i stanja te nepovratnost procesa. Pritom se velike molekule razgrađuju na manje, npr. metan se pri 1300 do 1400°C raspada na vodik i ugljik; drugi plinoviti alkani razgrađuju se već pri mnogo nižim temperaturama (400°C do 600°C). Riječ "Piroliza" dolazi od grčkih elemenata pyro (vatra) i lysis (razdvajanje). Na pirolizi tekućih alkana temelji se krekiranje naftnih frakcija. U kemijskoj industriji primjenjuje se i piroliza aromatskih ugljikovodika, alkohola, etera, aldehida, ketona, karboksilnih kiselina i njihovih soli.
Brza ili trenutačna piroliza (tzv. flash) uobičajena je tehnika pri dobivanju kapljevine iz čvrste biomase; pritom je vrijeme zadržavanja vrlo kratko (<2 s), uz veliku brzinu zagrijavanja pri 350°C do 500°C. Prvo umjetno dobivanje organskog spoja, ureje (F. Wohler, 1828.), ostvareno je pirolizom amonijeva cijanida. Piroliza se razlikuje od ostalih procesa kao što su izgaranje i hidroliza, jer obično ne uključuje reakcije s kisikom, vodom ili bilo kojim drugim reagensom. U praksi nije moguće postići potpunu atmosferu bez kisika. Budući da je neki kisik prisutan u bilo kojem sustavu pirolize, dolazi do male količine oksidacije.[1]
Proces[uredi | uredi kôd]
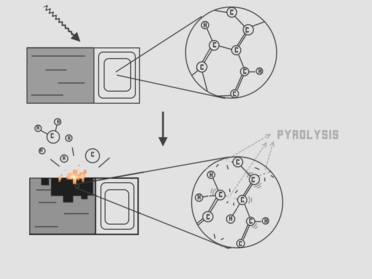
Piroliza pretvara organske tvari u njihove plinovite komponente, čvrste ostatke ugljika i pepela te kapljevinu koja se zove pirolitičko ulje (ili bio-ulje). Proces ima dvije primarne metode za uklanjanje kontaminanata iz tvari: uništavanje i uklanjanje. U metodi uništavanja organski zagađivači se raščlanjuju u spojeve male molekulske mase, dok se u postupku uklanjanja ne uništavaju, već se odvajaju od onečišćenog materijala. Piroliza je koristan postupak za tretiranje organskih materijala koji se raspadaju pod prisustvom topline. To sam sobom uključuje poliklorirane bifenile, dioksine i aromatske ugljikovodike. Iako nije korisna za uklanjanje ili uništavanje anorganskih materijala kao što su metali, može se koristiti u tehnikama koje čine takve materijale inertnim.[6]
Industrijski izvori[uredi | uredi kôd]

Mnogi izvori organske tvari mogu se koristiti kao sirovina za pirolizu. Neki od njih su:
| Biljni materijali | piljevina, otpadno drvo, drvenasti korov |
| Poljoprivredni izvori | ljuske oraha, slama, pamučno smeće, rižine ljuske, divlji proso |
| Životinjski otpad | smeće peradi, mliječni gnoj, potencijalno drugo gnojivo |
| Industrijski nusproizvodi | papirni mulj, destilatori zrna |
Primjena[uredi | uredi kôd]
Piroliza ima brojne primjene koje su vezane uz "zelenu" tehnologiju. Korisna je za izvlačenje materijala iz proizvoda kao što su automobilske gume, uklanjanje organskih kontaminanata iz tla te stvaranje biogoriva od usjeva i otpadnih proizvoda. Piroliza može pomoći u razlaganju automobilskih guma u korisne dijelove, čime se smanjuje ekološko zagađenje zbrinjavanjem starih guma. Gume su značajan proizvod odlagališta otpada u mnogim područjima jer otpuštaju teške metale u procesu spaljivanja. Međutim, kada se gume piroliziraju, one se razgrađuju u plin i ulje (upotrebljivo za gorivo) i čađu (upotrebljivu kao punilo polimernim proizvodima i kao aktivni ugljen u filterima i gorivim člancima).[7] Pored toga, piroliza može ukloniti organske zagađivače iz kanalizacijskog mulja i teške metale preostale u inertnom mulju što omogućuje sigurno korištenje mulja kao gnojivo.
Nadalje, piroliziranje biomase (biološki materijali poput drva i šećerne trske) ima veliku mogućnost za proizvodnju energetskih izvora koji bi mogli dopuniti ili zamijeniti energiju na bazi nafte. Piroliza uzrokuje celulozu, hemicelulozu i dio lignina u biomasi da bi se ona razgradila na manje molekule u plinovitom stanju. Kada se hladi, ti se plinovi kondenziraju do tekućeg stanja i postaju bio-ulje, dok ostatak izvorne mase (uglavnom preostali lignin) ostaje kao kruti biološki i nekondenzirani plin.
Drveni ugljen[uredi | uredi kôd]

Ljudi su koristili pirolizu za pretvaranje drva u ugljen na industrijskoj razini od davnih vremena. Osim drva, postupak također može koristiti piljevinu i ostale proizvode od drva. Drveni ugljen dobiva se zagrijavanjem drva dok se ne postigne potpuna piroliza (karbonizacija), ostavljajući samo ugljik i anorganski pepeo. U mnogim dijelovima svijeta drveni ugljen se još uvijek proizvodi poluindustrijski spaljivanjem puno drveta koja su uglavnom prekrivena blatom ili opekom. Toplina nastala paljenjem dijela drva i nestabilnim nusproduktima pirolizira ostatak drva. Ograničena količina kisika sprječava gorenje ugljena. Suvremenija alternativa je zagrijavanje drveta u zračnoj metalnoj posudi koja mnogo manje zagađuje i omogućuje da se hlapljivi proizvodi kondenziraju.
Zbog izvorne strukture drveta i pora nastalih ispuštanjem plinova završni proizvod postaje svijetli i porozan te jako krhak. [9]
Vatra[uredi | uredi kôd]

Piroliza je obično prva kemijska reakcija koja se javlja kod gorenja mnogih čvrstih organskih goriva, poput drva, tkanine i papira, kao i nekih vrsta polimera. U gorenju drva, vidljivi plamenovi nisu samo zbog izgaranja drveta, nego plinova koji se oslobađaju njegovom pirolizom. Stoga je piroliza uobičajenih materijala poput drva, polimera i odjeće iznimno važna za zaštitu od požara. Ne bi se trebala miješati s hidrotermalnim reakcijama kao što su hidrotermalno rasplinjavanje, hidrotermalna likvidacija i hidrotermalna karbonizacija koja se javljaju u vodenim okolišima jer se temperature i reakcijski procesi razlikuju s ionskim reakcijama.[2]
Kuhanje[uredi | uredi kôd]
Piroliza nastaje uvijek kada je hrana izložena dovoljno visokoj temperaturi u suhom okruženju, kao što je prženje, pečenje ili roštiljanje. To je kemijski proces koji je odgovoran za formiranje zlatno-smeđe kore u hrani pripremljenim tim metodama. U normalnom kuhanju glavni sastojci hrane koji podržavaju pirolizu su ugljikohidrati (uključujući šećere, škrob i vlakna) i proteini. Piroliza masti zahtijeva mnogo višu temperaturu jer proizvodi toksične i zapaljive proizvode te se općenito izbjegava u normalnom kuhanju. Konkretno, piroliza proteina i ugljikohidrata počinje na temperaturama znatno nižoj od temperature paljenja krutog ostatka, a hlapljivi proizvodi su previše razrijeđeni u zraku kako bi se zapalili. Piroliza ugljikohidrata i bjelančevina zahtijeva temperature znatno veće od 100 °C, tako da se ne pojavljuje sve dok je prisutna voda u kapljevitoj fazi. Ona se obično za većinu hrane ograničava na vanjskim slojevima hrane i počinje tek nakon što se ti slojevi isuše. Međutim, temperatura pirolize za hranu je niža od vrelišta za lipide, tako da se piroliza događa kod prženja u biljnom ulju. Piroliza također igra bitnu ulogu u proizvodnji ječmenog čaja, kave i prženih orašastih plodova kao što su kikiriki i bademi. Budući da se sastoje uglavnom od suhih materijala, proces pirolize nije ograničen na najudaljenije slojeve nego se proteže kroz materijale. U svim tim slučajevima, piroliza stvara ili oslobađa mnoge tvari koje doprinose okusu, boji i biološkim svojstvima konačnog proizvoda. Također može uništiti neke tvari koje su otrovne, neugodne u okusu ili one koje mogu doprinijeti kvarenju. Kontrolirana piroliza šećera, počevši od 170 °C, proizvodi karamel bež smeđih (u vodi topljivih) proizvoda koja se široko koristi u prehrambenoj industriji (u obliku bojila karamela) kao bojila za bezalkoholna pića i drugih prehrambenih proizvoda. Čvrsti ostatak od pirolize prolivene i prskane hrane stvara tamno smeđu crnu opnu koja se često vidi na posudama za kuhanje, štednjacima i unutarnjim površinama peći.
Ugljična vlakna[uredi | uredi kôd]

Ugljična vlakna se mogu koristiti za izradu vrlo jakih tekstila. Dobivaju se iz već oblikovanih drugih organskih vlakana, pretežito poliakrilonitrilnih vlakana velike čvrstoće, a u manjoj mjeri i od celuloznih viskoznih vlakana, te iz smolastog ostatka nakon pirolize nafte (tzv. mezofazna smola). Neovisno o vrsti ishodišnoga materijala, proces dobivanja provodi se termičkom obradbom u nekoliko stupnjeva (predobradba i karbonizacija). U njemu se pod strogo definiranim uvjetima i procesnim parametrima iz početnoga materijala postupno uklanjaju svi kemijski elementi osim ugljika, uz njegovu istodobnu postupnu ciklizaciju. Kod proizvodnje grafitnih vlakana, u završnoj se obradbi ciklička struktura ugljika grafitiranjem oblikuje u grafitnu. Prva ugljična vlakna su izrađena od zraka, ali poliakrilonitril je postao najčešći polazni materijal. Za svoje prve radne električne svjetiljke, Joseph Wilson Swan i Thomas Edison upotrijebili su ugljikove niti od pirolize pamučnih vlakna i od bambusa.[3]
Pirolitički ugljik[uredi | uredi kôd]

Pirolitički ugljik je materijal sličan grafitu, ali posjeduje kovalentnu vezu između njegovih grafitnih ploča kao rezultat nepravilnosti u njegovoj proizvodnji. Pirolitički ugljik je umjetni i ne može se naći u prirodi. Proizvodi se zagrijavanjem ugljikovodika gotovo na temperaturu razgradnje i dozvoljava kristalizaciju grafita (piroliza). Jedna metoda je zagrijavanje sintetičkih vlakana u vakuumu, a druga je metoda staviti sjeme na ploču u vrlo vrućem plinu kako bi se sakupila grafitna prevlaka. To se koristi kod proizvoda koji su izloženi visokim temperaturama kao što su: raketa, toplinski štit motora, laboratorijske peći te u biomedicinskim protezama.[8]
Ulje[uredi | uredi kôd]
Brza piroliza može se koristiti za pretvaranje širokog raspona sirovina biomase u tekuće ulje. Komponenta bogata fenolom može se izlučiti iz ovog ulja i koristiti kao jeftina zamjena za naftu. Nacionalni laboratorij za obnovljive izvore energije razvio je postupak ekstrakcije kako bi se oporavio ovaj dio fenola i pokazao značajke tih fenol-ulja u modificiranim ljepilima fenol formaldehida za drva.[5]
Ograničenja i zabrinutost[uredi | uredi kôd]
Tehnologija pirolize zahtijeva sušenje tla prije tretmana. Ograničeni podaci o značajkama sustava koji obrađuju opasni otpad, a koji sadrže poliklorirane bifenile, dioksine i ostale organske spojeve. Postoji zabrinutost da sustavi koji uništavaju klorirane organske molekule topline mogu stvoriti proizvode nepotpunog izgaranja, uključujući dioksine i furane. Taljevina se obično reciklira u reaktorskoj komori. Međutim, ovisno o obrađenom otpadu (osobito anorganskih) i količini pepela, potrošena rastopljena sol može biti opasna i zahtijevati posebnu pažnju zbrinjavanja. Piroliza nije učinkovita u uništavanju ili fizičkom odvajanju anorganske tvari od kontaminiranog medija. Hlapljivi metali mogu se ukloniti kao rezultat viših temperatura povezanih s postupkom. Nusproizvodi koji sadrže teške metale mogu zahtijevati stabilizaciju prije konačnog odlaganja. Kada se otpadni plinovi ohlade, kapljevina se kondenzira stvarajući ostatak ulja / katrana i onečišćenu vodu. Ova ulja i katrani mogu biti opasni otpad koji zahtijevaju pravilan tretman, skladištenje i odlaganje.[6]
Poveznice[uredi | uredi kôd]
Izvori[uredi | uredi kôd]
- "Pyrolysis", Encyclopaedia Britannica.
- Burning of wood, InnoFireWood's website.
- "Ugljična vlakna", enciklopedija.
- "Pyrolysis and Other Thermal Processing"
- "Use of Biomass Pyrolysis Oils for Preparation of Modified Phenol Formaldehyde Resins"
- "Pyrolysis"
- "Tire-Derived Fuel"
- "Pyrolytic carbon"
- "Biochar for Environmental management: Science and tecnology" Arhivirana inačica izvorne stranice od 11. prosinca 2017. (Wayback Machine)
