Niels Bohr
| Niels Bohr | |
 | |
| Rođenje | 7. listopada 1885. Kopenhagen, Danska |
|---|---|
| Smrt | 18. studenog 1962. Kopenhagen, Danska |
| Narodnost | Danac |
| Polje | Fizika |
| Institucija | Sveučilište u Kopenhagenu, Sveučilište u Cambridgeu, Sveučilište Victoria u Manchesteru |
| Alma mater | Sveučilište u Kopenhagenu |
| Akademski mentor | Joseph John Thomson, Ernest Rutherford |
| Poznat po | Bohrov model atoma, Načelo korespondencije, Bohrov radijus Bohrov magneton |
| Istaknute nagrade | Nobelova nagrada za fiziku 1922. |
| Portal o životopisima | |
Niels Bohr (Kopenhagen, 7. listopada 1885. – Kopenhagen, 18. studenog 1962.), danski fizičar. Profesor na sveučilištima u Cambridgeu, Manchesteru, Kopenhagenu i voditelj Instituta za teorijsku fiziku (od 1920.). Ideju kvantizacije, koju su Max Planck i Albert Einstein uveli za elektromagnetsko zračenje (foton), Bohr je primijenio na Rutherfordov planetni model vodikova atoma i objašnjavajući izmjerene valne duljine u spektru atomskoga vodika izveo načelo korespondencije koje povezuje klasičnu fiziku i kvantnu fiziku. Bohr je također uveo model kapljice tekućine za atomsku jezgru, koji je bio važan za razumijevanje nuklearnih procesa. Bio je vrlo aktivan u zalaganjima za međunarodnu suradnju i očuvanje mira u svijetu. Za zasluge u istraživanju strukture atoma i objašnjenje zračenja iz atoma dobio je Nobelovu nagradu za fiziku (1922). Bio je dopisni član Hrvatske akademije znanosti i umjetnosti i počasni doktor Sveučilišta u Zagrebu. Znatno je pomagao razvoju hrvatske teorijske fizike.[1]
Danski fizičar židovskog podrijetla koji se svojom kvantnom teorijom o građi atoma svrstao među utemeljitelje suvremene atomske fizike. Godine 1913. kao mladić se odlučio za drugu mogućnost u pokušaju rješavanja teškoće Rutherfordova modela. Bohr je zadržao osnovnu ideju planetnog sustava, ali je proširio ideju o kvantizaciji elektromagnetskog zračenja te je proširio Rutherfordov planetni model atoma. Pretpostavio je da su moguće samo neke kružne putanje elektrona oko atoma. Time je bitno izmijenio fizikalnu sliku atoma te je po njemu taj model nazvan Bohrov model.
Niels Bohr je radio na sveučilištu u Manchesteru zajedno s Rutherfordom u vrijeme njegova otkrića atomske jezgre. Godine 1936. neovisno o Breitu i Wigneru razvio je teoriju snažne interakcije nukleona u atomskoj jezgri i uveo pojam "složene jezgre" za međustanja u nuklearnim reakcijama. Za Drugog svjetskog rata, od 1944. do 1945. godine radio je na atomskom programu u Sjedinjenim državama (projekt Manhattan).
Za zasluge u istraživanju strukture atoma dobio je 1922. godine Nobelovu nagradu za fiziku, a i Zagrebačko Sveučilište mu je 1958. godine dodijelilo počasni doktorat.



Ideju kvantizacije, koju su Max Planck i Albert Einstein uveli za elektromagnetsko zračenje (foton), Bohr je primijenio na Rutherfordov planetni model vodikova atoma i objašnjavajući izmjerene valne duljine u spektru atomskoga vodika izveo načelo korespondencije koje povezuje klasičnu fiziku i kvantnu fiziku. U tu svrhu postavio je hipotezu da se elektron može gibati oko atomske jezgre samo po onim kružnim putanjama za koje je kutna količina gibanja cjelobrojni višekratnik veličine h/2π, gdje je h Planckova konstanta. Na taj način dobio je fizikalnu sliku atoma koja se naziva Bohrov model atoma. U tom modelu elektron se može gibati oko jezgre samo po kružnim putanjama određenih polumjera: r1 = a, r2 = 4 a, r3 = 9 a, i tako dalje, ili općenito po putanjama polumjera rn = n2a, gdje je a = 0,53 · 10–10 m (Bohrov radijus) i n je cijeli broj. Energija vodikova atoma u stanju s polumjerom rn = n2a iznosi En = –13,6 eV.
Vodikov atom emitira kvant elektromagnetskog zračenja (foton), kada elektron prelazi s neke više, n-te Bohrove putanje energije En, na neku nižu m-tu energije Em, i pritom emitira foton energije:
Iako se poslije pokazalo da Bohrov model može objasniti samo spektar vodikova atoma, imao je golemu važnost u razvoju fizike kao prvi pokušaj da se ideja o kvantizaciji primijeni na atome.
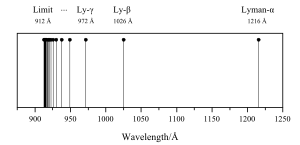
Balmerova serija u atomskoj fizici, predstavlja jednu od emisionih spektralnih linija vodika, koja nastaje skokom elektrona iz viših kvantnih energetskih razina u niže kvantne energetske razine. Balmerovu seriju se može izračunati s Balmerovom formulom, a to je empirijska formula koju je otkrio Johann Balmer 1885.[2] Vidljivi dio spektra vodika pokazuje četiri valne duljine: 410 nm, 434 nm, 486 nm i 656 nm, i pokazuje emisiju fotona, koja nastaje skokom elektrona s više energetske razine na energetsku razinu 2. Jedan dio Balmerove serije je u ultraljubičastom dijelu spektra, jer je valna duljina manja od 400 nm.












Užarena čvrsta tijela emitiraju svjetlost s kontinuirano raspodijeljenim valnim duljinama (toplinsko zračenje). Od temperature užarenog tijela zavisi koji je dio spektra najjači (najintenzivniji), ali od mjesta maksimuma postepeno se gasi svjetlost prema manjim i većim valnim duljinama. Nasuprot tome kontinuiranom spektru čvrstih tijela opaža se kod plinova i para nešto drugo. U njihovu se spektru pojavljuju diskretne linije, koje su svojstvene za pojedine kemijske elemente. Čitav spektar se sastoji od niza oštro određenih linija.
Lako je uvidjeti da linijski spektar potječe od atoma. Takvi se spektri dobivaju pri pokusima s katodnim i kanalnim zrakama. Električno izbijanje u katodnoj cijevi niskog tlaka izaziva uvijek velik broj atoma na emisiju svjetlosti. Linijske spektre emitiraju također i plemeniti plinovi, koji se sastoje od čistih atoma, a ne molekula.
Linijske spektre možemo studirati na emisijskom ili apsorpcijskom spektru. Pusti li se bijela svjetlost kroz neke pare ili plin, opaža se u dobivenom spektru da su neke valne duljine ugušene. Tamne linije stoje točno na onim mjestima spektra gdje bi ležale emisijske linije. Plin dakle apsorbira svjetlost onih valnih duljina koje bi inače emitirao. Apsorpcijski spektar slaže se potpuno s emisijskim. Ova određenost u spektrima kemijskih elemenata jedan je od temeljnih zakona nuklearne fizike.
Iako svakom kemijskom elementu pripadaju posebne, svojstvene spektralne linije, ipak se u njihovim spektrima opažaju neka zajednička svojstva, koja omogućuju da se unese red u golem spektroskopski materijal. Spektralne linije svakog kemijskog elementa daju se srediti u nekoliko serija. Svaka pojedina serija predstavlja niz linija koje su poredane po određenom pravilu. Često se već na prvi pogled vidi da linije jedne serije pripadaju zajedno. Promatramo li linije od većih valnih duljina prema manjim, udara nam odmah u oči da se razmak između njih smanjuje. Linije se gomilaju prema određenoj valnoj duljine, koja je granica te serije.
Prvi je J. J. Balmer 1885. otkrio da se vodikov spektar može prikazati jednostavnom matematičkom jednadžbom. Njemu su tada bile poznate 4 vidljive vodikove linije s valnim duljinama:
- Hα = 656, 199 nm
- Hβ = 486, 152 nm
- Hγ = 434, 067 nm
- Hδ = 410, 194 nm
Običaj je da se vodikove linije označe početnim slovima grčkog alfabeta, koja dolaze kao indeksi kemijskom simbolu H. Recipročne vrijednosti valnih duljina tih četiriju linija daje se jednadžbom (Rydbergova formula):
gdje je: m = 3, 4, 5, 6; a R je takozvana Rydbergova konstanta. Uvrstimo li u Balmerovoj jednadžbi za m cijele brojeve veće od 7 dobivamo valne duljine koje leže u ultraljubičastom području spektra. Pokusima se doista našlo još oko 30 linija koje se potpuno slažu s Balmerovom jednadžbom. Linije se gomilaju prema valnoj duljini koja je dana izrazom:
To je granica serije. Balmerova serija je idealni tip spektralnih linija uopće. Kako se vidi na slici, razmak između susjednih linija pravilno se smanjuje, i linije se gomilaju prema određenoj granici.
Iz razloga koji će se kasnije iznijeti uvedeno je da se spektralne jednadžbe postavljaju za frekvencije, a ne za valne duljine. Pokusima se, doduše, mjere valne duljine (iz interferentnih, ogibnih ili disperzionih pojava), ali zakoni spektralne analize postaju pregledniji kad se uzimaju u obzir frekvencije. Pri tom treba misliti na sljedeće: frekvencija ν se može izračunati iz valne duljine λ prema poznatom odnosu:
No brzina svjetlosti c nije tako točno izmjerena kako su točna mjerenja valne duljine. Točnost spektralne analize je nenadmašiva. Iz tog razloga i dalje se u spektralnoj analizi svi iskustveni podaci izražavaju u valnim duljinama.
Uvodeći frekvenciju, možemo Balmerovu jednadžbu pisati u obliku:
gdje je m = 3, 4, 5…. Frekvencije spektralnih linija vodika mogu se dakle prikazati kao razlike (diferencije) između dva člana, od kojih je prvi konstantan, a drugi opada kao 1/9, 1/16, 1/25, 1/36 …. Tu se odmah nameće pitanje: Mora li se uvijek uzeti kao konstantan broj 1/4? Moguće je pomisliti, da prvi konstantni član bude bilo koji razlomak 1/n2. Godine 1908. našao je F. Paschen u infracrvenom području spektralne linije vodika kojima su se valne duljine točno slagale s izrazima:
Tu dakle imamo dva člana jedne serije, kojoj je konstantni član R/32. Taj član ujedno određuje i granicu serije. I od te takozvane Paschenove serije nađen je vrlo velik broj linija. Godine 1916. pronašao je Lyman na drugoj strani od Balmerove serije, duboko u ultraljubičastom području, nove spektralne linije, koje smo mogli prikazati istom Balmerovovom jednadžbom, samo što je za konstantni član trebalo uzeti u nazivniku cijeli broj 1. Vodikov spektar sastoji se, od ovih serija:
Lymanova serija:
gdje je: m = 2, 3, 4 ….
gdje je: m = 3, 4, 5 ….
Paschenova serija:
gdje je: m = 4, 5, 6 ….
Brackettova serija:
gdje je: m = 5, 6, 7 ….
Pfundova serija:
gdje je: m = 6, 7, 8 ….
Od tog golemog mnoštva linija padaju u vidljivo područje spektra svega prve 4 linije Balmerove serije. Odatle se vidi kako je važno ispitivati čitav spektar da se nađu osnovni zakoni serije.
Frekvencije spektralnih linija vodika možemo općenito izraziti jednadžbom:
gdje su: n i m - cijeli brojevi.
Frekvencije vodikovih linija dobiju se, dakle, da se od niza c∙R/n2 učine sve moguće pozitivne razlike (diferencije). Tako objašnjena, Balmerova jednadžba vodi nas do općeg načela kombinacije, što ga je otkrio W. Ritz 1908. Po tom načelu dade se za svaki kemijski element postaviti niz terma T1, T2, T3, …. tako da su frekvencije njegova spektra dane razlikama (diferencijama):
Ritzovo načelo kombinacije potvrđeno je pri ispitivanju svih spektara. Ono je ključ za sređivanje različitih serija. Načelo kombinacije sadrži u sebi osnovni zakon prirode, koji se u punom smislu razotkriva tek u nuklearnoj fizici.
Kakve bismo spektre očekivali po klasičnoj teoriji? Razmotrimo najjednostavnije primjer, vodikov atom. Jedan elektron kreće se oko protona. U najjednostavnijem slučaju staza elektrona je kružnica. Gibanje elektrona u kružnici predstavlja pravilno harmonično titranje. Po klasičnoj teoriji elektromagnetsko polje oko atoma titra isto tako kao i elektron. Prema tome bi atomi emitirali svjetlost s frekvencijama koje bi se točno podudarale s frekvencijama titranja elektrona. No prema poznatom trećem Keplerovom zakonu frekvencija gibanja čestice dana je promjerom staze. Elektron se, naravno, u klasičnoj teoriji može okretati u bilo kojoj kružnici oko protona. Odatle izlazi, da bi mnoštvo vodikovih atoma emitiralo svjetlost sa svim mogućim frekvencijama. Upotpunimo još ovu sliku time da se elektroni kreću i u eliptičnim stazama. Tada njihovo gibanje nije više harmoničko. S druge strane, ono je i dalje periodičko i po Fourierovu teoremu može se prikazati kao beskrajna suma harmoničkih titranja s frekvencijama ν0, 2∙ν0, 3∙ν0, ….. gdje ν0 znači frekvenciju titranja elektrona oko jezgre. Kao i kod zvuka, tako bismo i ovdje očekivali pored osnovnog "tona" i "gornje tonove". Spektar vodikova atoma sastojao bi se, dakle, od beskrajnog mnoštva linija, koje bi imale među sobom jednaki razmak. Treba istaći da ovaj zaključak vrijedi i za složene atome i on se ne da izbjeći, ma kako proizvoljno odabrali model atoma.
Zakoni spektralne analize stoje u neizgladivoj suprotnosti s klasičnom teorijom. Iz tih suprotnosti rodila se moderna nuklearna teorija.
Ne protivi se klasičnoj fizici samo izgled optičkih spektara, nego i isto tako čudesna stabilnost atoma. Atomi nekog kemijskog elementa jednaki su. Oni imaju jednaka svojstva. Ta stabilnost atoma koja se prije činila prirodnom nije više sama po sebi razumljiva, otkako znamo da su atomi sastavljeni. Po klasičnoj teoriji elektron se može kretati u bilo kojoj elipsi koja ima žarište u jezgri. Prema tome bi se i atom u svakom pokusu pokazivao s drukčijim svojstvima. Međutim, mjesto te posvemašnje raznolikosti, koju bismo očekivali po klasičnim zakonima, u prirodi se pojavljuju atomi nekog kemijskog elementa s uvijek istim fizičkim i kemijskim osobinama. Ta čudesna stabilnost mikrosvijeta ukazuje nepobitno na granice klasične fizike.
Zamislimo načas da smo nekim vanjskim zahvatima uspjeli ostvariti u mnoštvu vodikovih atoma jednaka gibanja elektrona. U taj čas, naravno, svi su vodikovi atomi jednaki. Što će se dalje dogoditi? Shvatimo li atom kao klasični sistem, tad bismo vanjskim utjecajima mogli kontinuirano mijenjati oblik elipse elektrona. Gomilanjem sitnih vanjskih utjecaja s vremenom bi se znatno izmijenilo prvobitno stanje atoma; prvobitne jednakosti bi nestalo. No u stvarnosti to se ne događa. Atomi ostaju jednaki i tada kad se neprestano srazuju, kao u plinu. U svijetu atoma moraju biti na neki način postavljene granice principu kontinuiranog mijenjanja.
Isto tako nerazumljiva je u klasičnoj fizici osnovna činjenica da atomi u svojim stabilnim stanjima ne emitiraju svjetlost. Prema Rutherfordovu modelu morao bi se elektron stalno kretati oko jezgre, jer bi inače pao na nju. No svako ubrzano ili usporeno gibanje je po Maxwellovoj teoriji praćeno elektromagnetskim valovima. Želimo li dakle zadovoljiti klasičnu mehaniku, ogrešujemo se odmah o elektrodinamiku.
Stabilnost atoma, kao i emisiju i apsorpciju svjetlosti, možemo razumjeti samo onda ako u te procese unesemo osnovnu diskontinuiranost koju je M. Planck otkrio u zračenju crnog tijela. Planck je pretpostavio da harmonički oscilator može poprimiti samo diskontinuirane vrijednosti energije. A. Einstein je išao još korak dalje s hipotezom da se svjetlost sastoji od kvanta energije h∙ν. Ako je ta hipoteza točna, tad atomi mogu samo trenutno, u izvjesnim kvantnim skokovima, emitirati ili apsorbirati svjetlost. Emisija i apsorpcija svjetlosti tada je diskontinuiran proces, s jedne strane zato što atom ne može kontinuirano mijenjati svoju energiju, a s druge strane zato što atom emitira svjetlost kao kvant energije.
Poopćivši Planckovu hipotezu diskontinuiranosti, postavio je N. Bohr za osnov kvantne teorije ove postulate:
- Atomi mogu boraviti samo u određenim stacionarnim stanjima koja se među sobom oštro razlikuju. Prepušteni sami sebi, nalaze se atomi u stabilnom stanju, to jest u stanju najniže energije. Izvanjskim utjecajima možemo atome prevesti samo u stacionarna stanja više energije. Za to potrebna energija jednaka je razlici energije stacionarnih stanja.
- Nalazi li se atom u nekom pobuđenom stacionarnom stanju, on prelazi sam od sebe u stacionarno stanje niže energije emitirajući pri tom kvant svjetlosti. Energija kvanta svjetlosti jednaka je razlici (diferenciji) između energije višeg i nižeg stacionarnog stanja.
Energiju stabilnog stanja atoma označit ćemo s E1, drugog stacionarnog stanja s E2, trećeg s E3 i tako dalje. Pri prijelazu iz stacionarnog stanja s energijom En u stacionarno stanje Em atom emitira kvant svjetlosti energije:
Odatle izlazi za frekvenciju svjetlosti izraz:
Ova jednadžba predstavlja drugi Bohrov postulat, koji stoji u potpunoj paraleli s iskustveno potvrđenim Ritzovim načelom kombinacije. Prema iskustvu, frekvencije spektralnih linija mogu se prikazati razlikama (diferencijama) dvaju terma iz niza T1, T2, T3, …., Isto to veli i drugi Bohrov postulat. Prema tome se spektralni termi moraju podudarati s energijama atoma. Ovo stajalište otvara sasvim novi vidik na zakonitosti spektralne analize.
Bohrovim postulatom zadobio je Ritzovo načelo kombinacije temeljno fizičko značenje. Prikazivanje frekvencija kao razlika spektralnih terma drugi je oblik Bohrov postulat. Negativni umnožak spektralnog terma s Planckovom konstantom jednak je energiji pojedinog stacionarnog stanja atoma:
U iskustvenom zakonu spektroskopije već je davno prije postanka kvantne teorije izrečen temeljni zakon nuklearne fizike. Skupivši i vrlo točno odredivši odredivši spektralne terme atoma, spektroskopičari su tim samim skupili mnoštvo zakona o energijama atoma. Na osnovu spektroskopskog materijala mogu se najtočnije odrediti atomske diskretne energije, a to određenje energija iz spektralnih terma premašuje samu astronomsku točnost.
Emitirane frekvencije mogu se vrlo pregledno prikazati grafičkom slikom u kojoj su energije stacionarnih stanja atoma nanesene kao vodoravne paralelne linije. Udaljenošću između dvaju energetskih nivoa određen je umnožak između frekvencije i Planckove konstanta. Balmerovoj seriji odgovaraju prijelazi iz viših energetskih nivoa na drugi energetski nivo odozdo. Veličine strelice koje označuju prijelaz proporcionalne su emitiranim frekvencijama. Prijelazi na najniži energetski nivo daju frekvencije koje leže u ultraljubičastom. Najveća frekvencija tih prijelaza dana je prijelazom atoma iz najvišeg stacionarnog stanja u stabilno stanje. Taj proces nastaje na primjer kad proton uhvati koji slobodan elektron u svojoj okolini. Frekvencije svjetlosti emitirane prilikom prijelaza u treći energetski nivo, n = 3, leže u infracrvenom dijelu spektra. Isto tako, naravno, vrijedi i za prijelaze k ostalim višim energetskim nivoima. Od mnoštva vodikovih spektralnih linija samo četiri linije padaju u vidljivi dio spektra.
Mi smo dosad promatrali samo spontane prijelaze iz energetskih viših stacionarnih stanja u niža uz emisiju kvanta svjetlosti. Obrnut proces od toga je apsorpcija. Poznata je činjenica da atomi apsorbiraju svjetlost samo onih frekvencija koje inače mogu emitirati. Obasjavamo li vodikove atome svjetlošću koja ima frekvenciju upravo jednaku razlici (diferenciji), c∙R - c∙R/22, c∙R - c∙R/23 ili c∙R - c∙R/24, to mogu vodikovi atomi prijeći iz stabilnog stanja u prvo, drugo ili treće pobuđeno stacionarno stanje. Energije kvanata svjetlosti upravo su tako velike da atomi, apsorbiravši ih, prelaze iz stabilnog stanja u energetski viša stanja. Ako je energija kvanta veća ili manja od tih energija, tada se ne opaža apsorpcija svjetlosti. U stabilnom stanju ne mogu na primjer vodikovi atomi apsorbirati 4 vidljive Balmerove linije. Energija kvanata te svjetlosti ne dostaje da atom prevedemo iz stabilnog u koje pobuđeno stanje. U stabilnom stanju vodikovi atomi apsorbiraju samo ultraljubičaste Lymanove linije. Podudaranje između emisijskog i apsorpcijskog spektra najbolja je potvrda kvantnoteorijskih predodžbi o emisiji i apsorpciji atoma.
Atomi mogu apsorbirati kvante svjetlosti kada se nalaze i u kojem višem energetskom nivou. Ako je na primjer atom prešao apsorpcijom u prvi pobuđeni energetski nivo, tada može ponovnom apsorpcijom kvanta svjetlosti prikladne energije prijeći u drugi pobuđeni energetski nivo. Za ta dva skoka potrebna je svjetlost dviju frekvencija, kod vodika na primjer c∙R i c∙R/22 - c∙R/23. U isto vrijeme ćemo, dakle, atome obasjavati svjetlošću koja ima te dvije frekvencije. Atomi koji su prešli u energetski viša stanja vraćat će se u stabilna stanja. Iz drugoga pobuđenog stanja može atom prijeći ili direktno u stabilno stanje ili najprije u prvo pobuđeno stanje. U drugom slučaju emitira atom iste frekvencije svjetlosti koje je i apsorbirao. U prvom slučaju, naprotiv, emitira atom svjetlosti koja ima frekvenciju jednaku sumi iz frekvencija apsorbiranih svjetlosti. Pojavljivanje tih triju spektralnih linija opaža se zaista u pokusu i ono govori vrlo uvjerljivo u prilog kvantnog shvaćanja atomskih procesa. Samo u okviru kvantne teorije dade se shvatiti da atom može emitirati svjetlost s frekvencijom jednakom sumi frekvencija svjetlosti koje je prethodno apsorbirao.
Kvantnom teorijom našle su jednostavno tumačenje vrlo zanimljive pojave fluorescencije. Obasjavamo li neke tvari svjetlošću, opažamo da atomski sistemi mogu apsorbiranu energiju djelomično ili sasvim emitirati u obliku svjetlosti. Pomislimo da smo kemijsku tvar obasjavali monokromatskom svjetlošću. U mnogo slučajeva tvari zrače opet svjetlost s tom istom frekvencijom kakvu ima svjetlost obasjavanja. Međutim je češće da tvar emitira svjetlost s frekvencijama različitim od prvotne apsorbirane svjetlosti. Za te frekvencije vrijedi Stokesovo pravilo da su emitirane frekvencije uvijek manje od frekvencije svjetlosti kojom smo obasjavali tvar. Tako na primjer može tvar zračiti crvenu svjetlost, iako je prije bila obasjana plavom (modrom). Prema kvantnoj teoriji možemo tu pojavu lako obasjasniti. Atomski sistemi ne vraćaju se izravno u prvotna stabilna stanja, već po izvjesnim okolišnim putovima, pa se prvotna energija apsorbiranog kvanta svjetlosti razdijeli u više manjih doza energije, koje se postepeno emitiraju.[3]
Načelo korespondencije je načelo koje povezuje novu i staru teoriju mehanike, posebno kvantnu i klasičnu mehaniku. Prema tom načelu, nova teorija mora moći objasniti sve pojave koje je objašnjavala prevladana teorija. Tako kvantna fizika i klasična fizika podjednako uspješno opisuju sustave većih objekata u kojima se Planckova konstanta i valna duljina tvari mogu smatrati zanemarivima. Granica primjene tih dviju teorija vrlo su veliki kvantni brojevi. Za vrlo velike kvantne brojeve promjene vrijednosti fizikalnih veličina tako su malene da gotovo nisu diskretne, odnosno mogu se smatrati kontinuiranima, pa su rezultati zakona kvantne i klasične fizike jednaki. Prema načelu korespondencije nerelativistička i relativistička fizika daju jednake rezultate kad su brzine u promatranome fizikalnom sustavu zanemarivo malene s obzirom na brzinu svjetlosti.[4]

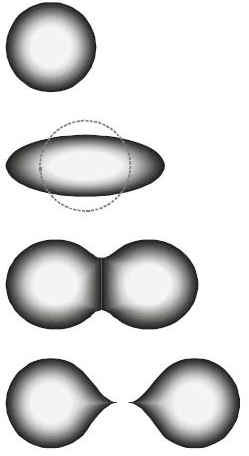
Mehanizam nuklearne fisije objašnjava se teorijom nuklearne fisije, koju su iznijeli Niels Bohr i John Archibald Wheeler 1939., koju su je nazvali model tekuće kapljice atomske jezgre. Oni su pretpostavili da je djelovanje nuklearnih sila slično djelovanju privlačnih sila između molekula u kapljici vode, koja zauzima oblik kugle i suprotstavlja se svojoj promjeni oblika. Kad u atomsku jezgru uranija-235 uleti spori neutron, on svoju energiju preda nukleonima u toj jezgri. Zbog toga nastaje njihovo brže kretanje i jezgra uranija-235, koju treba promatrati kao kapljicu tekućine oblika kugle, prolazi kroz niz promjena stanja i oblika. Kapljica se najprije izdužuje u elipsoid (oblik jajeta). Ako u kapljici ne postoji dovoljna količina energije da se svlada sila napetosti površine, ona će poslije titranja zauzeti ponovno svoj sferni oblik. Ali pri dovoljnoj količini energije, sila koja vrši promjenu oblika izazvat će udubljivanje kapljice u sredini i kapljica će dobiti oblik sličan kao kikiriki. U tom slučaju, elektrostatička odbijajuća Coulombova sila može svladati rezidualnu jaku nuklearnu silu, pa će se kapljica rascijepiti u dva dijela, koja će biti izbačena u različitim smjerovima. Dva fisijska fragmenta će dobiti na kraju oblik kugle. Tako će nastati dva odvojena atomska jezgra različitih elemenata, koji će težiti stabilnijem stanju, pa će izbaciti jedan ili više neutrona.
Smatra se da nesimetrična priroda nuklearne fuzije nastaje zbog toga što se atomska jezgra sastoji od nekoliko slojeva. Pretpostavlja se da se simetrično cijepaju samo vanjski slojevi, a unutrašnji dio jezgre se uopće ne cijepa, nego izlijeće zajedno s jednom polovinom nukleona iz vanjskih slojeva. Fisioni fragmenti izlijeću velikom brzinom i zagrijavaju okolinu u kojoj nastaju.
Fisioni fragmenti uranija-235 zbog velikog broja neutrona, kojih je više nego u stabilnim izotopima elemenata, su vrlo nestabilni. Svi fisioni fragmenti su elektronski aktivni i poslije niza uzastopnih beta-raspada prelaze u stabilne izotope. To znači da svaki fisioni fragment ima svoj svojstveni radioaktivni niz. Pošto se pri emisiji beta-čestica mijenja atomska masa tog atoma, normalno je da se atomski broj takvog atoma povećava za jedan. Pri nuklearnoj fisiji uranija-235 otkriveno je preko 300 različitih aktivnih produkata fisije.
Kako pri nuklearnoj fisiji nastaje velik broj beta-čestica i gama-čestica, ova jaka radioaktivnost stvara zatrovanje (kontaminaciju), zbog čega dolazi do oštećenja ljudskog organizma, koji su im izloženi. Zbog toga osoblje koje radi u nuklearnim reaktorima mora upotrebljavati zaštitna sredstva.[5]
- ↑ Bohr, Niels, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2015.
- ↑ C.R. Nave (2006). "HyperPhysics" Hydrogen Spectrum. Georgia State University, 2008.
- ↑ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.
- ↑ načelo korespondencije, [2] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2015.
- ↑ [3][neaktivna poveznica] "Uvod u nuklearnu energetiku", Prof. dr. sc. Danilo Feretić, 2011.
- Web courseware Povijest fizike Arhivirana inačica izvorne stranice od 2. kolovoza 2012. (Wayback Machine)



















