Bojilo












































Bojilo je organska tvar koja se upotrebljava za bojenje tekstila, kože, krzna, papira, polimernih materijala (plastike), živežnih namirnica (hrane), farmaceutskih preparata i slično. Za razliku od boja i lakova, koji se u tankom sloju nanose na površinu materijala, bojila ulaze u materijal, tvore s njim kemijsku vezu, vežu se fizikalno (privlačnim silama) ili unutar materijala tvore netopljive spojeve. Njihova je primjena bila poznata prije više tisuća godina (indigo u Egiptu, Kini i Indiji, purpur na Kreti). Prirodna bojila bila su tijekom mnogih stoljeća glavna bojila za bojenje tekstila, a tek u drugoj polovici 19. stoljeća razvijaju se sintetska bojila.
Nositelji su obojenosti u bojilu kromofori, svojstvene nezasićene atomske skupine (na primjer azo, nitro, nitrozo, karbonilna), koje su obično povezane s aromatskim jezgrama i pospješuju mezomeriju u konjugiranom sustavu. Osim što treba sadržavati kromofor, neka kemijska tvar može biti bojilo u tehničkom smislu ako postoji mogućnost da se veže i ugradi u materijal.[2]
Bojila su kemijske tvari koje apsorbiraju (upijaju) svjetlost u vidljivom dijelu spektra te su stoga obojene, a imaju sposobnost da boje tekstilna vlakna ili druge materijale manje ili više trajno, ulazeći s obojanim materijalom u kemijsku vezu ili vežući se na nj stalnim fizičkim silama.[3]
Neka je kemijska tvar obojena ako djelomično (selektivno) upija (apsorbira) vidljivo svjetlo, to jest ako elektromagnetsko zračenje određenih valnih duljina između 380 i 760 nm upija, a propušta ili odbija (reflektira) elektromagnetsko zračenje ostalih valnih duljina u tom dijelu spektra; to zračenje kad djeluje na mrežnicu ljudskog oka izaziva osjet (kromatske) boje. Boja koju doživljava promatrač odgovara boji apsorbiranog svjetla, na primjer ako tvar apsorbira modro svjetlo valne duljine 480 nm, ona (osvijetljena bijelim svjetlom) izgleda narančastožuta. Tvari čije molekule apsorbiraju fotone valnih duljina izvan područja vidljivog svjetla, bilo u ultraljubičastom (valna duljina ispod 380 nm) bilo u infracrvenom području (iznad 760 nm), izgledaju ljudskom oku bezbojne, ali se takva apsorpcija energije zračenja može mjeriti pogodnim mjernim instrumentima. Sposobnost neke molekule da apsorbira fotone energije zračenja zavisi od njene sposobnosti da pređe u pobuđeno stanje, to jest od mogućnosti da neki njen elektron pređe na molekularnu orbitu višeg energetskog stanja nego što ga on zauzima u normalnom, nepobuđenom ili osnovnom stanju molekule. Pretpostavlja se da takav prijelaz može uzrokovati samo foton čiji je sadržaj energije točno jednak razlici između energije elektrona na pobuđenom i njegove energije na nepobuđenoj energijskoj razini. Mogući su dakle samo prelazi elektrona za koje je:
gdje je λ - valna duljina apsorbiranog fotona, h - Planckova konstanta, c - brzina svjetlosti, a ΔE - razlika između energija elektrona u normalnoj i pobuđenoj razini.
Oni organski spojevi koji u svojim molekulama imaju samo σ-veze sadržavaju čvrsto vezane elektrone. Energijske razine koji tim elektronima stoje na raspolaganju udaljeni su jedan od drugog, njihove razlike ΔE su velike te odgovaraju vrlo malim vrijednostima valne duljine λ. Zbog toga takve tvari apsorbiraju samo u dalekom ultraljubičastom području (duljina vala ispod 150 nm). π-elektroni su, općenito uzevši, slabije vezani i njima raspoložive energijske razine manje su udaljene jedne od drugih, pa se apsorpcija pomiče prema većim valnim duljinama, to jest prema vidljivom dijelu spektra. Ako molekula sadrži nekoliko dvostrukih veza, ta je pojava jače izražena, osobito ako su te dvostruke veze konjugirane. Tako etilen H2C=CH2 apsorbira zračenje valne duljine 175 nm, butadien H2C=CH—CH=CH2 zračenje valne duljine 220 nm, heksatrien H2C=CH—CH=CH—CH=CH2 zračenje valne duljine 258 nm i tako dalje. U ugljikovodicima s duljim konjugiranim lancem energijske razine π-elektrona su tako blizu jedan drugome da vrijednost razlike između njihovih energija odgovara valnim duljinama vidljivog svjetla, pa su takve tvari obojene. Tako na primjer l,8-difeniloktatetraen-l,3,5,7 apsorbira svjetlost valne duljine 434 nm, te je žuto obojen. Odlučna pri tom je razlika između osnovnog (nepobuđenog) i prvog pobuđenog energetskog nivoa. Tvar koja apsorbira u vidljivom dijelu spektra mora imati bar jednu energijsku razinu koja sadrži od 160 do 470 kJ/mol više energije od osnovnog. Kako i osnovno stanje i prvo pobuđeno stanje neke molekule svako za sebe sadrže različita stanja rotacijske i vibracijske energije, apsorpcija nije ograničena na određenu oštru valnu duljinu, nego je proširena na manje ili više široku apsorpcijsku vrpcu.
Za nastajanje boje važna je i prisutnost hetero-atoma (N,0,S) u konjugiranom lancu. Tako na primjer formaldehid, CH2=0, apsorbira svjetlost s λ = 190 nm, a i mnogo bliže vidljivom dijelu spektra, s λ = 300 nm. Prva od ovih dviju vrpca apsorpcije odgovara vrijednosti od 175 nm za etilen, a potječe vjerojatno od prelaza jednog od valencijskih π-elektrona na višu energijsku razinu. Druga vrpca smatra se da potječe od prelaza jednog labavijeg nevalencijskog p-elektrona kisikova atoma na višu energijsku razinu. Kako su ovi elektroni u molekuli slabije vezani nego valencijski elektroni, treba za njihovo prelaženje na višu energijsku razinu manje energije, što odgovara većoj valnoj duljini. Ovakvih nevalencijskih p-elektrona nema u etilenu, pa on zato ni ne pokazuje odgovarajuću apsorpciju. Konjugacija —C=0 pomiče ovu vrpcu koja zavisi od sekundarne apsorpcije prema većim valnim duljinama. Diacetil (I) apsorbira svjetlost s λ = 280 nm (analogno apsorpciji kod 220 nm u butadienu) i između 400 i 460 nm. Kako se ova druga vrpca nalazi u modroljubičastom području, spoj je žut. Isto je tako žut i p-benzokinon (II) u kojem dva karbonila nisu neposredno jedan uz drugog, ali su ipak konjugirani. Prisutnost N-atoma u konjugiranim sistemima ima sličan utjecaj. Tako na primjer stilben (III) ima vrpcu apsorpcije kod 300 nm te je bezbojan, a azobenzen (IV) apsorbira kod 450 nm te je narančast.
Povećano područje konjugacije također utječe na pomak područja apsorpcije prema većim valnim duljinama, kako se vidi u nizu (na slici) kondenziranih aromatskih cikličkih sistema.
Područje se konjugacije proširuje i u slučaju kad se u nekom konjugiranom lancu nalaze dušikovi ili kisikovi atomi s usamljenim elektronskim parovima, to jest p-elektronima koji nisu ušli u valencijsku vezu, kao na primjer u sistemima na slici.
Tako je na primjer p-nitrotoluen (V) vrlo slabo svijetložuto obojen, dok je p-nitranilin (VI) narančastožut, a njegov kation (VII) svijetložut.
Boja se produbljuje (to jest apsorpcijska se vrpca pomiče prema većim valnim duljinama) kad je usamljeni elektronski par olabavljen prisutnošću negativnog naboja. Stoga je na primjer p-nitrofenol obojen slabo svijetložuto, a njegov anion izrazito narančastocrveno.
Da bi p-elektroni takvih dušikovih ili kisikovih atoma mogli snažnije djelovati na produbljivanje boje, potrebno je da na drugom kraju konjugiranog lanca bude neki elektronegativni atom koji teži da privuče elektrone, kao na primjer: = 0: ili = N+ vezani dvostrukom vezom na konjugirani lanac, preko kojeg se privlačno djelovanje prenosi. Osim veličine područja na kojem se nalaze konjugirani π-elektroni u molekuli, prisutnosti nevalencijskih p-elektrona i prisutnosti elektronegativnih atoma, obojenost može uvjetovati i račvanje konjugacije, odnosno hiperkonjugacija. Tako je na primjer najjednostavniji obojeni ugljikovodik fulven, u kojem račvanje konjugiranog lanca uzrokuje apsorpciju svjetla mnogo većih valnih duljina nego što bi se očekivalo prema apsorpcijama butadiena, heksatriena ili ciklopentadiena. Ovo se račvanje naziva i unakrsna konjugacija: njena prisutnost često dovodi do produbljivanja boje. Smatra se da je to tako na primjer s indigom. Djelovanje se hiperkonjugacije na obojenost očituje u činjenici da se metiliranjem amino grupa nekog bojila dobivaju dublje obojeni produkti. Uzrok je tome što (σ-veze CH3 grupa imaju stanoviti π-karakter, pa se donekle konjugiraju s ostalim π-elektronima, a to dovodi do toga da metilirani produkti apsorbiraju svjetlo većih valnih duljina.
Jednu od najranijih teorija o vezi između građe organskih molekula i boje iznio je 1878. O. Witt. On je utvrdio da obojeni organski spojevi sadrže stanovite nezasićene grupacije, koje je nazvao kromoforima. Početkom 20. stoljeća istaknuta je i važnost kinonoidne grupe. Kasnije se spoznalo da molekula nekog organskog spoja, da bi on bio obojen, mora sadržavati određen broj kromofora povezanih međusobno tako da su im dvostruke veze konjugirane. Tvari koje u molekuli sadrže kromofore nazvane su kromogenima. One ne moraju nužno biti obojene. Witt je pokazao da neke grupacije koje mogu tvoriti soli (kao na primjer —NH2, —NHR, —NR2, —OH, gdje je R alkilni ili arilni ostatak) ne mogu same po sebi uvjetovati obojenost, ali mogu izazvati obojenost nekog bezbojnog kromogena ili produbiti obojenost nekog obojenog spoja. Ove su grupe nazvane auksokromima. Pozitivno djelovanje na dubinu obojenosti naziva se batokromijom. Auksokromne se grupe mogu po rastućem batokromnom utjecaju poredati ovako:
- —OH, OR, —O-, —NH2, —N (CH3)2, —NH·C6H5,
a to znači, prema modernoj teoriji, da tim redom raste težnja p-elektrona slobodnih elektronskih parova da sudjeluju u mezomeriji molekule.
Bojila mogu biti prirodna ili se proizvode sintetski.
Podjela prema porijeklu najstarija je podjela koja danas ima tek povijesno značenje.
Prirodna bojila dobivaju se izdvajanjem biljnih ili životinjskih sastojaka, na primjer iz sadnica u cvatu (prirodni indigo), korijenja, lišća, puževa (purpur), insekata (karmin) i tako dalje. U bojenju tekstila prirodna bojila imaju danas ograničenu važnost, a više se upotrebljavaju za bojenje živežnih namirnica, kozmetičkih i farmaceutskih proizvoda. Prirodna bojila, iako su prva otkrivena, ukupno su iskorištena u vrlo maloj količini, jer su skupa i slabije učinkovitosti. Prirodna bojila su obojeni organski spojevi koji se nalaze u stanicama biljaka i životinja, te u mikroorganizmima. Prirodna bojila mogu se u njima nalaziti u slobodnom obliku (kurkumin) ili u spoju sa šećerom i bjelančevinama. Neka su bojila (indigo, antikni purpur) bezbojna, pa se od njih dobiva obojen spoj oksidacijom, fermentacijom ili fotokemijskim postupkom.[4]
Umjetna bojila ili sintetska bojila pojavljuju se nakon sinteze mauveina iz anilina (W. H. Perkin, 1856.). Njihova se tržišna primjena temeljila na proizvodnji velikih količina anilina iz katrana kamenog ugljena kao sirovine (otuda naziv katranske, odnosno anilinske boje). Nakon otkrića diazotacije i alizarinske sinteze u drugoj polovici 19. stoljeća, ostvarena je industrijska sinteza indiga, kongo-crvenila, indantrena i mnogih drugih bojila. Disperzijska bojila uvedena su 1923., a reakcijska 1956. Bojila za tekstil u Hrvatskoj proizvodi od 1950. zagrebačka tvornica "Chromos – Organske boje". Umjetna bojila su jeftinija i velike učinkovitosti, stoga danas drže vodeći položaj u proizvodnji.
Sintetska bojila mogu se podijeliti prema materijalu koji se njima boje na bojila za tekstil, za kožu, za papir, za plastične mase, za hranu, za ulja, masti, voskove, tekuća goriva i maziva, za premazna sredstva i naliče i za druge specijalne svrhe. Bojila za tekstil mogu se podijeliti na bojila za biljna vlakna, za životinjska vlakna, za sintetička vlakna i za miješana vlakna ili tkanine. Među bojila za specijalne svrhe idu bojila za mikroskopiju, za fotografiju, za kozmetiku, za pirotehniku, za farmaceutske svrhe, za kemijsku analizu (indikatori).
Prema svojstvima bojanja dijele se bojila u ove grupe:
- bojila topljiva u vodi:
- bazna,
- kisela,
- močilna,
- metalkompleksna,
- supstantivna (direktna),
- reaktivna,
- leukoesteri reduktivnih bojila (indigosoli);
- bojila topljiva u alkoholu;
- bojila netopljiva u vodi:
- bojila koja se redukcijom mogu prevesti u leukospojeve topljive u vodi (reduktivna i sumporna bojila),
- disperziona bojila,
- bojila topljiva u mastima i uljima,
- pigmentna bojila,
- bojeni lakovi;
- bojila koja se grade na vlaknu (materijalu):
- naftol-AS bojila,
- acetatna bojila za razvijanje,
- oksidaciona bojila,
- bojila koja nastaju u diazotipiji,
- bojila za višeslojnu fotografiju u bojama.
Bazna bojila se bazičnom kationskom skupinom vežu na anione akrilnih vlakana. Bazična bojila su vodotopiva kationska bojila uglavnom korištena za bojanje vlakana od akrila, te ponekad vune i svile. Kao močilo koristi se uglavnom octena kiselina. Koriste se za bojanje papira. Bazna bojila sadrže slobodne i supstituirane amino-grupe, a upotrebljavaju se najčešće u obliku u vodi topljivih soli (s octenom, oksalnom, sumpornom ili solnom kiselinom, odnosno kao dvosoli s cinkovim kloridom). U vodi topljive soli boje vunu, svilu, papir i kožu, a pamuk tek nakon obrađivanja močilima (sriješom, taninom, sintetskim štavilima). Slobodne baze topljive su često u organskim otapalima (alkoholima, esterima, ketonima i tako dalje), a djelomično i u uljima, mastima i voskovima; upotrebljavaju se za bojenje lakova, plastičnih masa, voskova i parafina, a također u štamparskim bojama. Disperzije baznih bojila u vodi boje acetatni rejon. Uvođenjem dovoljnoga broja sulfonskih grupa u molekulu postaju ta bojila topljiva u vodi i dobivaju svojstva bojanja kiselih bojila. Bazna bojila čine najstariju grupu bojila, a odlikuju se jasnim i živahnim tonovima, ali su im postojanosti, osobito na svjetlost, slabe. Upotrebljavaju se poglavito kad se pridaje veća važnost živahnom tonu obojenja nego postojanosti. Baznih bojila ima u gotovo svim kemijskim grupama. Po raspodjeli bojanja spadaju među bojila topljiva u vodi samo soli baznih bojila.
Kisela bojila su vodotopiva i anionska. Ovoj kategoriji pripada većina sintetskih bojila. Primjenjuju se kod bojanja svile, vune, najlona i modificiranog akrila u kiseloj sredini. Kemijska veza ostvaruju se uglavnom stvaranjem organske soli spajanjem aniona u bojilu i kationa u vlaknu. Kisela bojila sadrže u molekuli jednu ili više sulfonskih grupa –SO3H koje uzrokuju njihovu topljivost u vodi i njihovo svojstvo bojanja. Kemijski spadaju najvećim dijelom među azo (monoazo i disazo)-bojila, antrakinonska, triarilmetanska i ksantenska bojila. Glavna im je upotreba za bojanje životinjskih vlakana, prije svega vune i svile, koje se bojaju iz kisele kupke direktno. Posebne vrste kiselih bojila se upotrebljavaju za kožu, životinjska celvlakna, poliamidna vlakna i papir. Neka kisela bojila bojadišu vunu i iz neutralne posude.
Močilna bojila koriste močilo. Takvim bojilima pripada većina prirodnih bojila. Močilna bojila imaju svojstvo da na vlaknu tvore s pogodnim metalnim spojevima (prije svega solima kroma, a također solima aluminija, bakra i željeza) manje ili više teško topljive složene spojeve i tako daju obojenja dobrih mokrih postojanosti, a u većini slučajeva i bolje postojanosti na svjetlu nego što ih imaju obojenja istim bojama bez metala. Kako se kao močilo najčešće upotrebljavaju kromne soli, ova bojila se često nazivaju i kromnim bojilima. Po kemijskoj građi pripadaju ta bojila azo-bojilima, triarilmetanskim, ksantenskim i antrakinonskim bojilima. Većina tih bojila sadrži u orto- ili peri-položaju ili dvije hidroksilne grupe, ili dvije karboksilne grupe, ili jednu hidroksilnu i jednu karboksilnu grupu. U bojilima iz reda azo-spojeva mora biti u obje jezgre prisutna po jedna od navedenih dviju grupa u o, o'-položaju, odnosno u peri-položaju, s obzirom na azo-skupinu, ili pak mora u jednoj jezgri biti jedna od ovih grupa u spomenutom položaju, a u drugoj amino grupa. Druga hidroksilna grupa nastaje katkada zbog oksidacije dikromatom za vrijeme naknadnog kromiranja nakon bojanja. Bojila ovakve građe nazivaju se i ortooksi-bojila. Najveći dio prirodnih bojila spada također u grupu močilnih bojila. Bojila ove grupe su od naročitog značenja za bojanje vune, pri čemu se kao metal upotrebljavaju kromi-[Cr(III)] soli ili dikromati, koje vuneno vlakno i dodane reduktivne supstancije u samoj kupelji reduciraju u kromi-soli. Obojenja su dobrih postojanosti, naročito obojenja onim bojilima antrakinonskoga reda koja se izvode od alizarina. Neka prirodna bojila pripadaju također ovoj grupi. Mnogo rjeđe se ova bojila upotrebljavaju za pamuk prethodno obrađen močilima i za prirodnu svilu, kazeinsko i poliamidno vlakno. Posebni se asortimani upotrebljavaju za bojanje kože i anodno oksidiranog aluminija.
Metalokompleksna bojila stvaraju kelate između metalnih iona (krom, kobalt, bakar). Metalokompleksna bojila predstavljaju grupu kromnih i kobaltovih kompleksa (pretežno) ortooksiazo-bojila. Prema sadržaju kompleksno vezanoga metala u molekuli bojila dijele se ova u:
- metalkompleksna bojila 1 : 1, koja se veoma dobro tope u vodi i s kojima se boja vuna iz veoma kiselih kupelji (palatinska i neolanska bojila), i
- metalkompleksna bojila 1 : 2, koja se teže tope u vodi, a bojanje se njima iz slabo kiselih do neutralnih kupelji (cibalani, irgalani, izolani, ortolani).
Oba tipa bojila daju na vunenom materijalu vrlo postojana obojenja, a primjenjuju se i na poliamidna i modificirana poliakrilonitrilna vlakna. Naročito dobre postojanosti postižu se na sintetičkim vlaknima metalkompleksima 1 : 2 koji se ne tope u vodi, ali koji su pripremljeni u finim disperzijama.
Direktna bojila ili supstantivna bojila fizikalno se vežu izravno na celulozno vlakno. Direktna bojila koriste neutralne ili slabo lužnate sredine blizu ili na točki vrelišta otopine natrijevog klorida ili natrijevog sulfata. Koriste se za bojanje pamuka, papira, kože, vune, svile i najlona. Uporabu nalaze i kao indikatori pH vrijednosti, te kao bojila u mikroskopiji.
Reaktivna bojila koriste kromofor povezan s nekom reaktivnom kemijskom skupinom koja se kovalentno veže na vlakno. Pripadaju najtrajnijim bojilima. Reaktivna bojila imaju posebnu atomsku grupu, takozvanu reaktivnu komponentu, vezanu za molekulu bojila, koje je po kemijskoj građi većinom azo-bojilo, rjeđe antrakinonsko, ftalocijaninsko ili metalkompleksno u vodi topljivo bojilo. Reaktivna komponenta je najčešće s-triazinaki prsten s jednim ili dva reaktivna atoma klora, ili vinilsulfonski ostatak; ona se kemijski veže s hidroksilnim grupama celuloznoga vlakna ili aminogrupama vune i poliamidnoga vlakna. Od izbora obojene komponente zavisi postojanost reaktivnih bojila na svjetlosti, a sve mokre postojanosti znatno su poboljšane zbog kemijske veze s vlaknom preko reaktivne grupe u molekuli bojila.
Indigosoli ili leukoesteri reduktivnih bojila su soli estera sumporne kiseline s leukospojevima koji nastaju redukcijom karbonilnih skupina indigoidnih i antrakinonskih bojila. Karakterizira ih prisutnost grupacije Me03S0—C=C—C=C—OSO3Me (Me = kalij ili natrij). Vežu se iz neutralne kupelji na pamuk ili iz slabo kisele kupelji na vunu i svilu, a zatim se u drugoj kupelji, koja sadrži kiselinu, izvrši hidroliza estera i zbog prisutnosti oksidirajućih sredstava (natrijeva nitrita, natrijeva dikromata, feriklorida) istodobno oksidira hidroksilna grupa u karbonilnu. Njihove postojanosti odgovaraju postojanostima onih reduktivnih bojila od kojih se izvode. Upotrebljavaju se najčešće za bojanje pamuka, lana, regeneriranih celuloznih vlakana, a rjeđe za vunu i svilu. Odlikuju se izvanrednom sposobnošću egalizacije (izjednačivanja) i prodiranja u tkivo, pa se zato upotrebljavaju za pastelne nijanse, a vrlo se dobro primjenjuju i za bojanje komadne robe. Stanovitu upotrebu imaju i u bojanje kod štampanja (tisak).
Bojila topljiva u alkoholu mogu se naći u svim kemijskim skupinama. Većina ih pripada azo-bojilima, a ima ih iz reda nigrozina i indulina, triarilmetanskih i ksantenskih bojila. Služe za prozračno bojenje celuloznih estera, celuloida, prirodnih i sintetičkih smola i tako dalje.
Reduktivna bojila obuhvaćaju u vodi netopljiva bojila koja se s natrijevim "hidrosulfitom" (natrijevim ditionitom, Na2S204∙2H20) u prisutnosti alkalija prevode u reducirani oblik, takozvani leuko-oblik, koji je topljiv u vodi. Iz takve se otopine bojila vežu na materijal i na njemu se kisikom iz zraka oksidiraju natrag u netopljivo bojilo. Za bojenje vune su upotrebljivi samo oni produkti koji se mogu prevesti u topljiv oblik u prisutnosti amonijaka na nižoj temperaturi. Najvrednija bojila za celulozna vlakna, bojila s najvećim postojanostima, pripadaju kemijskoj grupi antrakinonskih bojila, a i niz indigoidnih bojila se upotrebljava na isti način za istu svrhu. Reduktivna bojila za vunu pripadaju grupama indigoidnih, benzokinonskih i naftokinonskih bojila.
Sumporna bojila su dvokomponentna bojila za bojanje pamuka u tamne boje. Sumporna bojila prevode se redukcijom u topljiv oblik, vežu se na celulozna vlakna i zatim oksidacijom ponovno postaju netopljiva. Sumporna bojila se prevode u oblik topljiv u vodi djelovanjem otopine natrijeva sulfida, koji reducira sulfidni sumpor u merkaptanski, pa u prisutnosti alkalija nastaju u vodi topljive natrijeve soli merkaptana (tioli). Zbog alkalne reakcije ovako nastalih otopina upotrebljavaju se sumporna bojila isključivo za bojenje biljnih vlakana u tamnim nijansama.
Disperzijska bojila su u obliku vodenih disperzija, iz kojih čestice bojila prelaze u omekšana sintetska vlakna i u njima tvore čvrste otopine. Disperzna bojila se melju u prah u nazočnosti tvari koja pomaže disperziju, te skladište kao pasta, sprej ili prah. Uglavnom se koriste za bojanje poliestera. Disperzijska bojila u vodi su netopljiva ili teško topljiva, pa se za bojenje upotrebljavaju u obliku finih vodenih suspenzija u prisutnosti disperzionih sredstava (sapuna, deterdženata). Suspendiranu boju materijal apsorbira (upije) nakon što je ona prodrla u intermicelarne šupljine. Kemijski su to jednostavna antrakinonska bojila, monoazo-bojila i azometinska bojila, a imaju obično veći broj supstituenata: amino-, alkoksi-, hidroksialkil-, halogen, nitro- ili cijano-skupina. Primjenjuju se za bojanje acetatne svile i sintetičkih vlakana.
Bojila topljiva u uljima i mastima pripadaju najvećim dijelom azo-bojilima i upotrebljavaju se za bojanje tehničkih masnoća, goriva i živežnih namirnica (hrane).
Pigmentna bojila su potpuno ili gotovo potpuno netopljiva u sredstvu (mediju) u kojem se primjenjuju. Po kemijskoj građi pripadaju grupama azo-bojila, antrakinonskih, indigoidnih i ftalocijaninskih bojila. Upotrebljavaju se u premaznim bojama, naličima, lakovima, grafičkim bojama, bojama za tapete, bojama za bojanje plastičnih masa. U tekstilnoj se industriji upotrebljavaju za tisak i za bojanje sintetičkih vlakana prije postupka predenja.
Bojeni lakovi su teško topljive ili netopljive soli bojila koja su inače topljiva u vodi, ili njihovi složeni (kompleksni) spojevi. Upotrebljavaju se za iste svrhe za koje se upotrebljavaju i pigmentna bojila, ali im nedostaje postojanost prema kiselinama i lužinama, koje ih cijepaju u prvotno topljivo bojilo i odgovarajući metalni spoj. Bojeni lakovi se proizvode iz reda azo-, antrakinonskih, kridinskih, azinskih, kinoftalonskih, nitro-, nitrozo-, tiazinskih i triarilmetanskih bojila.
Naftol AS ili naftol-AS bojila su netopljiva azo-bojila koja nastaju kopulacijom nekog topljivog diazonijevog spoja na jednu topljivu aktivnu komponentu direktno na vlaknu ili tkanini. Kako komponente ne sadrže grupacije koje omogućuju otapanje u vodi (sulfonske –SO3H i karboksilne grupe -COOH), nastaju na vlaknu zapravo pigmentna bojila. Upotrebljavaju se u prvom redu za bojanje celuloznih materijala, manje za svilu, a određene kombinacije se upotrebljavaju i za bojanje acetatnog rejona i sintetičkih vlakana. Dobivena obojenja vrlo su postojana prema svim utjecajima, često koliko i najbolja reaktivna bojila. Značajna je i njihova upotreba za štampanje u boji (tisak).
Acetatna bojila za razvijanje analogna su naftolima AS, s razlikom da se kao aktivne komponente za kopulaciju upotrebljavaju relativno jednostavni aromatski fenoli i derivati acetoctenog estera. Upotrebljavaju se za bojanje vlakna od celuloznog acetata i poliamidnih vlakana, a u manjoj mjeri i poliesterskih vlakana. Postojanosti su im odlične, ali je asortiman uzak.
Oksidacijska bojila nastaju na materijalu kad se neki aromatski amini i diamini, odnosno aminofenoli, kondenziraju i oksidiraju u toku procesa bojenja pomoću oksidacijskih sredstava (kromata, klorata) u prisutnosti metalnih soli kao katalizatora. Upotrebljavaju se za bojanje celuloznih materijala i krzna. Postojanosti su im općenito dobre.
Bojila koja nastaju u diazotipiji su relativno jednostavna azo-bojila koja nastaju na papiru impregniranom stabilnim diazonijevim spojevima, kopulacijskim komponentama (floroglucinom, rezorcinom, acetoacetanilidom, derivatima naftola i tako dalje) i kiselinama koje sprečavaju kopulaciju (citronskom, vinskom) nakon što je na osvijetljenim mjestima razoren djelovanjem svjetla diazonijev spoj i zatim omogućena kopulacija izlaganjem parama amonijaka.
Bojila za višebojnu fotografiju nastaju kad dietil-p-fenilendiamin, ili p-aminofenol, ili njihovi derivati supstituirani u jezgri ili na alkilnim grupama djeluju na pogodne komponente s kojima se vežu u azometinska, indofenolska ili indaminska bojila.
Prema kemijskoj građi sintetska se bojila mogu podijeliti u ove grupe: nitrozo-bojila, nitro-bojila, azo-bojila (monoazo-bojila, disazo-bojila, trisazo-bojila, poliazo-bojila, bojila koja se grade na vlaknu), metinska i polimetinska, tiazolska, tiazinska, azinska, oksazinska, sumporna bojila, amino-bojila, hidroksiketonska, antrakinonska bojila, leukoesteri reduktivnih bojila, indigoidna, ftalocijaninska, stilbenska, di- i triarilmetanska, ksantenska, akridinska, kinolinska, reaktivna i metalkompleksna bojila.
Azo-bojila (prema fr. azote: dušik) su organska sintetska bojila koja sadrže najmanje jednu azo-skupinu, –N=N–, vezanu na aromatsku jezgru, te jednu auksokromnu skupinu. Proizvode se diazotacijom nekoga aromatskog amina i vezanjem nastaloga diazonijeva spoja na neku aktivnu kopulacijsku (veznu) komponentu. Procesi diazotacije i kopulacije mogu se primijeniti na mnogo azo-spojeva koji sadrže amino-skupine ili slobodno mjesto za kopulaciju, a mogu se i nekoliko puta ponavljati, što vodi do velikog broja diazo-bojila i poliazo-bojila različite građe. Azo-bojila se uobičajeno dijele prema broju azo-skupina u molekuli, o čemu ovisi i njihova boja. Najbrojnija su skupina sintetskih organskih bojila, s najširom primjenom, ponajprije za bojenje vune i pamuka, ali i svile, kemijskih vlakana i prehrambenih namirnica (prehrambeni aditivi). Otprilike 70% svih bojila koja se koriste u tekstilnoj industriji po svom su sastavu azo-bojila.
Teorijski se azo-bojila izvode od azobenzena C6H5N=NC6H5 kao najjednostavnijeg aromatskog azo-spoja. On nastaje alkalnom redukcijom nitrobenzena i nema svojstvo bojila. No ako se na njemu nalaze supstituirane (zamijenjene) hidroksilne –OH, amino- NH2, sulfonske –SO3H, karboksilne -COOH ili sulfonamidne grupe, ili ako su benzenski prsteni izociklički ili heterociklički aromatski kondenzirani pa i supstituirani u tim sistemima s navedenim grupacijama, dobivaju se spojevi sa svojstvom bojila. Pretpostavlja se da su azo-bojila benzenoidnokinonoidno tautomerna s odgovarajućim hidrazonima kinona, odnosno njihovim derivatima. Prema upotrebi i vrsti materijala koji se boja imaju azo-bojila najširi raspon primjene. Za svako vlakno, sintetično ili prirodno, za otapala, kao pigmenti i tako dalje upotrebljavaju se odgovarajuća azo-bojila.
Nitrozo-bojila sadrže nitrozo-grupu u o-položaju prema hidroksilnoj grupi fenola ili naftola. Orto-nitrozo-fenoli i –naftoli tvore s metalnim hidroksidima obojene helatne spojeve, a isto tako i s metalnim solima slabih kiselina. Pri tom nitrozo-spojevi reagiraju vjerojatno u tautomernom o-kinon-monoksimskom obliku. Samo zeleni željezni lakovi nekih nitrozo-naftola su našli upotrebu kao bojila i za tisak, tako na primjer C. I. 10006 (pigmentna zelena B), koji se dobiva djelovanjem natrijeva nitrita u kiselom mediju na β-naftol, prevođenjem nastalog nitrozo- naftola u bisulfitni spoj i obradom željeznim sulfatom u prisutnosti natrijeva hidroksida, i pigmentna zelena B, C.I. 10020 (pigmentna zelena PLX), koji se priprema nitroziranjem Schaefferove kiseline (2-naftol-6-sulfonske kiseline) i prevođenjem nastalog nitrozo-derivata u natrijevu-željeznu sol djelovanjem željeznog sulfata u prisutnosti natrijeva hidroksida. Ovo se bojilo također dodaje morskoj vodi na solanama da bi se pojačala apsorpcija (upijanje) toplinskih zraka i time ubrzalo isparavanje vode djelovanjem Sunčeve svjetlosti.
Nitro-bojila su aromatski amini ili fenoli koji sadrže u o- ili p-položaju jednu nitro-grupu ili više njih. Dobivaju se djelovanjem dušične kiseline na fenole, naftole, diazotirane aromatske amine ili diarilamine, djelovanjem aromatskih amina na aromatske klor-nitro-derivate i, konačno, kondenzacijom nitro-amina s formaldehidom. Tako na primjer 1 -naftol-2,7-disulfonska kiselina daje nitriranjem 2,4-dinitro-l-naftol-7-sulfonsku kiselinu, čija je natrijska sol naftol žuta S, C.I. 10316. Kondenzacijom p-aminofenola s 2,4-dinitroklorbenzenom nastaje C.I. 10345 (njem. Cellitonechtgelb RR). Slično nastaje iz 2,4-dinitroklorbenzena i 4-aminodifenilaminsulfonske kiseline C.I. 10385 (njem. Amidogelb E). Kondenzacijom 4-klor-2-nitranilina s formaldehidom priprema se C.I. 10325 (njem. Litholechtgelb GG). Nitro-bojila koja sadrže sulfonske grupe –SO3H upotrebljavaju se za bojanje životinjskih vlakana. Nesulfurirani nitro-diaril-amini su disperzijska bojila za polusintetička i sintetička vlakna. Neka nesulfurirana nitro-bojila su pigmenti. Nijanse nitro-bojila su od žute preko narančaste do smeđe. Tržišno ta bojila nisu od velikog značenja.
Ovu grupu bojila karakterizira prisutnost stilbenskih grupacija koje se odvode od stilbena, trans-1,2-difeniletilena (I), uz istodobnu prisutnost jedne ili više azo- ili azoksi-grupa. Pripremaju se tako da se u alkalnom mediju kondenzira 5-nitrotoluen-o-sulfonska kiselina (II), bilo sama bilo s drugim aromatskim spojevima (obično arilaminima), ili tako da se prvi produkti koji nastaju obradom 5-nitro-o-toluensulfonske kiseline alkalijama, 4,4'-dinitrostilben-2,2'-disulfonska kiselina (III) i 4,4'-dinitrobibenzil-2,2'-disulfonska kiselina (IV), kondenziraju s arilaminima i aminoazo-spojevima. Često se kondenzacija provodi u prisutnosti reduktivnih sredstava, kao što su to na primjer formaldehid, glukoza i slično. Konstitucija stilbenskih bojila je većim dijelom nepoznata ili tek približno poznata; ona se sastoje najčešće od smjesa različitih spojeva. Sva su bojila ove grupe direktna, a neka se upotrebljavaju i za kožu. U nijansama su ograničena na žuto, narančasto, žućkastocrveno i smeđe. Glavni su predstavnici: Curcumin S, C.I. 40000, dobiva se grijanjem 5-nitrotolueno-sulfonske kiseline s otopinom natrijeva hidroksida kojoj se koncentracija postepeno povećava; ako se ta autokondenzacija provodi u prisutnosti formaldehida, dobiva se Stilbengelb 3 GX, C.I. 40001. Siriuslichtorange RRL, C.I. 40235, priprema se kuhanjem alkalne otopine 4,4'-dinitrostilben-2,2'-disulfonske kiseline s monoazo-bojilom p-anisidin-2-sulfonska kiselina → 2,5-ksilidin; ako se umjesto ksilidina upotrijebi krezidin, nastaje Siriuslichtscharlach 2G, C.I. 40270. Siriuslichtbraun 3R, C.I. 40290, nastaje analogno ako se kao monoazo-bojilo upotrijebi produkt sulfanilna kiselina → a-naftilamin.
Difenilmetanska ili ketoniminska bojila su derivati difenilmetana. Jedini produkt iz ove grupe koji ima stanovitu važnost jest bazno bojilo Auramin O, C.I. 41000. Priprema se tako da se djeluje sumporom, amonijevim kloridom i kuhinjskom soli na 4,4'-tetrametildiaminodifenilmetan u atmosferi amonijaka i prevođenjem tako nastale ketoniminske baze u hidroklorid. Intermedijarno nastaje tetrametildiaminotiobenzofenon. Iako auramin nema dobrih postojanosti na svjetlu i nije stabilan (hidroliza iminske grupe u vodenoj otopini teče brzo iznad 60°C), upotrebljava se mnogo za bojenje papira zbog jeftinoće i briljantnog žutog obojenja.
Triarilmetanska bojila su bojila koja se izvode strukturno od bezbojnog trifenilmetana (C6H5)3CH. Najčešća među njima su trifenilmetanska, a manji dio pripada derivatima difenil-naftilmetana C10H7·CH·(C6H5)2. U para-položaju prema centralnom ugljikovu atomu moraju se u molekuli nalaziti na arilnim grupacijama najmanje dvije auksokromne skupine. Kromofor je ove skupine p-kinonoidna grupacija O=C6H4=O, odnosno 0=C6H4=NH. Prema broju i karakteru auksokromnih grupa dijele se ta bojila na trifenilmetanske derivate s dvije amino-grupe, na iste derivate s tri amino-grupe, na hidroksi-trifenilmetanske derivate, aminohidroksi-derivate i derivate difenilnaftilmetana. U svakoj od ovih grupa nalaze se bojila različitih svojstava bojenja: bazna, kisela, močilna i bojeni lakovi. Ako molekula bojila sadrži grupu —COOH u o-položaju prema grupi —OH, bojilo je močilno. Uvođenjem sulfonskih grupa u molekulu dobivaju se od baznih bojila kisela. Sulfonske grupe koje se nalaze u o-položaju prema centralnom ugljikovom atomu povećavaju postojanost prema alkalijama. Bojeni lakovi nastaju od baznih bojila taloženjem s fosformolibdenskom ili fosforvolframskom kiselinom. Trifenilmetanskim bojilima postižu se neobično živahna, briljantna i čista obojenja crvene, ljubičaste, modre i zelene boje, ali su im postojanosti općenito niske, osobito na svjetlu i prema alkalnoj obradi. Zbog toga im upotreba sve više opada u korist postojanih bojila. Bazni predstavnici se najviše upotrebljavaju za bojenje svile i močenog pamuka, a kiseli i močilni za bojenje vune. Najveće količine ovih bojila troše se izvan tekstilne upotrebe, i to za bojenje papira, drveta, šibica, u proizvodnji grafičkih boja, za tinte, kao boje u kozmetici i prehrambenoj industriji.
Ksantenska bojila formalno su ciklički analozi di- i trifenilmetanskih spojeva; u njima su dva aromatska prstena spojena jednim atomom kisika u orto-položaju prema metanovom ugljiku. Teorijski se izvode od heterocikličkog sistema ksantena, dibenzo-y-pirana, ali se od njega ne pripravljaju. Sam ksanten je bezbojan, no derivati s auksokromnim grupama u molekuli su obojeni. Prema supstituentima koji se nalaze u molekuli dijele se ksantenska bojila u tri podgrupe. Prva sadrži hidroksi-derivate, druga amino-derivate, a treća amino-hidroksi-derivate. Kromofor je ovih bojila u slučaju aminoderivata rezonantni hibrid oksonijskog, amonijskog i karbonijskog oblika molekule (I, II, III). Hidroksi-derivati se gubitkom protona stabiliziraju dajući električki nenabijen sistem čiji je kromofor kinonoidna struktura IV.
Ova su bojila i po svojstvima bojenja bliza arilmetanskim bojilima. Obojenja koja se njima postižu vrlo su čista i jarka. Najbrojnije su zastupana crvena i ružičasta s nekoliko žutih i ljubičastih. Neka od ovih bojila snažno fluoresciraju u otopini, pa i na obojenom materijalu. I u ovoj se grupi nalaze bojeni lakovi pripremljeni taloženjem s fosfor-volfram-molibdenskom kiselinom. Niz crvenih i narančastih bojila ove skupine važan je za bojenje kozmetičkih preparata, živežnih namirnica i ljekovitih pripravaka.
Među značajnije predstavnike ksantenskih bojila ide sulforodamin B, C.I. 45100; priprema se tako da se kondenzira benzaldehid-2,4-disulfonska kiselina s m-dietilaminofenolom, produkt dehidrira sumpornom kiselinom, oksidira željeznim kloridom i prevede u natrijevu sol. Rodamin B, C.I. 45170, jedno od prvih bojila ove grupe, dobiva se kondenzacijom anhídrida ftalne kiseline s m-dietilaminofenolom; ako se kao aminska komponenta upotrijebi 3-etilamino-p-krezol i tako nastali produkt esterificira alkoholom, nastaje rodamin 6G, C. I. 45160. Echtsáureviolett ARR, C.I. 45190, dobiva se obradom fluoresceina fosfornim trikloridom, kondenzacijom tako nastalog 3',6'-diklorfluorana s o-toluidinom i sulfuriranjem. Fluorescein, C. I. 45350, priprema se kondenzacijom anhídrida ftalne kiseline s rezorcinom. Njegove alkalne soli, poznate pod imenom uranin neobično jako fluoresciraju u otopini (i u razređenju 1 : 40 000 000), pa se stoga upotrebljavaju za označavanje i ispitivanje vodenih tokova. Bromiranjem fluoresceina priprema se tetrabromfluorescein, eozin G, C.I. 45380, a jodiranjem dijodfluorescein, Eritrozin 6G, C. I. 45425. Coerulein S, C.I. 45510, nastaje obradom Galleina (C.I. 45445) koncentriranom sumpornom kiselinom. Gallein se dobiva kondenzacijom pirogalola ili galne kiseline s anhidridom ftalne kiseline.
Akridinska bojila sadrže kao kromofornu grupu akridin u kinonoidnom obliku, a auksokromi se nalaze u p-položaju prema centralnom ugljikovom atomu. Nemaju velikog praktičnog značenja, tek ih se nekolicina upotrebljava za bojenje kože i papira u žutim i narančastim nijansama. Primjeri su: Rhodulinorange NO, C.I. 46005 (koji se priprema time što se kondenzira N,A/-dimetil-m-fenilendiamin s formaldehidom, ciklizira uz otcjepljenje amonijaka grijanjem s kiselinama i konačno oksidira zrakom) i Diamantphosphin GG, C.I. 46035 (koji se dobiva kondenzacijom m-toluilendiamina s formaldehidom i metiliranjem dimetilsulfatom). Neka akridinska bojila imaju stanovitu upotrebu u medicinske svrhe zbog svog snažnog antiseptičkog djelovanja, tako na primjer Acriflavin, C.I. 46000.
Metinska bojila i polimetinska bojila su bojila za koja je svojstvena konjugirani lanci, djelomično ili potpuno otvoreni lanci grupa -CH=, koji završava s jedne strane amonijevom grupom a s druge dušikovim, sumpornim ili kisikovim atomom, ili nekom jednakovrijednom (ekvivalentnom) nezasićenom grupom. Većina ovih bojila sadrži kinolinski, benzotiazolni ili trimetilindolinski sustav prstena koji su spojeni metinskim ili polimetinskim lancima. Sve su to bazna bojila od kojih neka imaju važnu ulogu kao senzibilizatori u fotografiji, a za tekstilne i ostale svrhe bojanja imaju samo ograničenu primjenu u tisku i kao pigmentna ili disperzijska bojila, a u novije vrijeme i za bojenje poliakrilnitrilnoga vlakna. Nijanse su im žute, narančaste i crvene. Kao primjer navidi se Astraphloxin FF ex., C.I. 48070. Ovo se bojilo priprema polazeći od fenilhidrazona metiletilketona, koji ciklizacijom daje 2,3,3-trimetilindolenin, na čiju se N-metilamonijsku sol (dobivenu djelovanjem metilklorida ili dimetilsulfata) djeluje najprije trietilnim esterom ortomravlje kiseline, pa solnom kiselinom.
Tiazolska bojila sadrže kao kromofor tiazolski prsten koji je u položaju 2 vezan na aromatski prsten, a u položaju 4,5 kondenziran s aromatskim prstenom. Auksokrom im je aminogrupa. Osnovni proizvod za ova bojila, dehidrotio-p-toluidin, dobiva se grijanjem p-toluidina sa sumporom. Dehidrotio-p-toluidin se može upotrijebiti kao diazotacijska komponenta, no tako dobivena bojila svrstavaju se u azo-bojila. Daljim djelovanjem sumpora na višim temperaturama nastaju kondenzacijski produkti koji sadrže više tiazolskih prstena, takozvane primulinske baze. Djelovanjem sredstva za sulfoniranje na te baze nastaju direktna bojila za pamuk, koja se mogu na vlaknu diazotirati i kopulirati s aminima i fenolima u azo-bojila. Postignuta obojenja su žuta, narančasta, crvena ili smeđa. Takva se bojila mogu pripremiti i u supstanciji, i onda se ubrajaju u azo-bojila. Prisutnost tiazolskog prstena povećava supstantivnost, pa se on ugrađuje u molekule azo-bojila, metinskih, antrakinonskih, cijaninskih i sumpornih bojila. Tiazolska su bojila otporna prema blagim reduktivnim sredstvima i upotrebljavaju se zbog toga u obojenom tiskanju za bojanje jetkanih mjesta. Najvažniji je proizvod ove malobrojne grupe bojila primulin, C.I. 49000.
Azinska bojila imaju pirazinski prsten koji kondenziran s aromatskim jezgrama daje kromofor, fenazin. Supstitucijom amino-grupa i hidroksi-grupa u aromatske jezgre u p-položaju prema N-atomu u prstenu dobivaju se bojila. Prvo sintetičko bojilo koje se proizvodilo za komercijalne potrebe spada u ovu grupu. To je mauvein, što ga je pripremio 1856. W. H. Perkin oksidacijom sirovog anilina (koji je sadržavao smjesu izomernih toluidina) natrijevim dikromatom u hladnoj razrijeđenoj sumpornoj kiselini. Danas se više ne upotrebljava.
Bezbojni ili slabo obojeni azinski spojevi s kiselinama tvore snažno obojene soli. Azinska su bojila bazna bojila koja proteinska vlakna bojaju direktno a pamuk tek nakon močenja taninom. Daju obojenja crvena, modra i ljubičasta. Iz ove je grupe tehnički važan safranin T, C.I. 50240, koji se priprema djelovanjem natrijeva nitrita na orto-toluidin-hidroklorid, redukcijom nastalog aminoazotoluena željeznom piljevinom i oksidacijom natrijevim bikromatom uz dodatak anilina, sve u jednom slijedu bez izolacije intermedijara. Spomenuti treba iz ove grupe i Wollechtblau BL, C.I. 50315, koji se dobiva kondenzacijom l,3-dianilino-naftalin-8-sulfonske kiseline s 4-aminodifenilamin-2-sulfonskom kiselinom i naknadnom oksidacijom; upotrebljavaju se i neka druga slično građena bojila.
U ovu grupu spadaju također nigrozini i indulini. To su ljubičasta do modrocrna bojila koja nastaju kondenzacijom nitrobenzena ili aminoazobenzena s anilinom i anilinklorhidratom. Upotrebljavaju se za bojenje papira, kože, plastičnih masa, zatim u proizvodnji hektografskih masa, laštila za kožu i grafičkih boja. Takav je produkt na primjer Indulinbase NF, C.I. 50400; priprema se kratkim grijanjem p-aminoazobenzena sa smjesom anilina i hidroklorida anilina. Iz anilina i hidroklorida anilina uz nitrobenzen priprema se grijanjem na 180 - 200 °C u prisutnosti bakarnih soli; Nigrosinbase N, C.I. 50415, bojilo netopljivo u vodi, a topljivo u uljima, mastima i mnogim otapalima. Iz ovog se bojila nakon sulfuriranja i prevođenja sulfonskih grupa u natrijeve soli priprema u vodi topljivi Nigrosin GF (Indulin WL), C.I. 50420. U ovu grupu bojila spada i postojano anilinsko crnilo, C.I. 50440, koje nastaje oksidacijom anilina na vlaknu u prisutnosti bakarnih ili vanadijevih soli kao katalizatora. Kao sredstvo za oksidaciju upotrebljava se najčešće kalijev dikromat ili kalijev klorat.
Oksazinska bojila sadrže kao kromofor fenoksazonijsku grupu često kondenziranu s aromatskim sistemima. Stabilizacija rezonantnih kinonoidnih oblika, u kojima se ta bojila kao soli s jakim kiselinama nalaze, povećava se prisutnošću auksokromnih skupina (—N < i —OH) u m-položaju prema kisiku, odnosno u p-položaju prema dušiku. Važnost ima danas još samo mala grupa dioksazinskih bojila, u kojima su dva oksazinska sistema kondenzirana. To su briljantna, vrlo postojana bojila za direktno bojenje pamuka i vune. Primjer za njih je Siriuslichtblau FF2GL, C.I. 51300, koji se priprema kondenzacijom p-aminodifenilamin-o-sulfonske kiseline s tetraklor-p-benzokinonom (kloranilom) u vodenoj otopini uz magnezijev oksid i zatim ciklizacijom tako dobivenog intermedijarnog produkta s pomoću oleuma.
Antrakinonska bojila, na primjer alizarin, su bojila koja se dobivaju na osnovu antrakinona. Antrakinon je blijedožuta kristalna tvar netopljiva u vodi, slabo topljiva u alkoholu, eteru i acetonu. Dobiva se oksidacijom antracena s pomoću natrijeva dikromata i sintetski iz anhidrida ftalne kiseline i benzena. Prema svojstvima bojanja mogu se svrstati u 4 glavne grupe: močilna antrakinonska bojila, kisela antrakinonska bojila, bojila za acetatnu svilu i reduktivna antrakinonska bojila.
Aminoketonska i hidroksiketonska bojila sadrže kao kromofor benzokinonske ili naftokinonske karbonilne grupe, a kao auksokrome -NH2, -NHR ili -OH. Ona koja sadrže amino-grupe primjenjuju se najvećim dijelom kao reduktivna bojila. Hidroksiketonska bojila nemaju gotovo nikakvog praktičnog značenja. Najveći dio aminoketonskih bojila su žuta, kaki i smeđa. Neka se dobivaju djelovanjem sumpora ili sulfida (kao sumporna bojila) na produkte kondenzacije kloriranih kinona s aromatskim aminima. Tako na primjer nastaje Helindonkhaki CR, C.I. 56015, djelovanjem sulfidnih reagensa na produkt kondenzacije p-kloranilina i kloranila, tako da se atomi klora djelomično zamijene atomima sumpora. Ta se bojila primjenjuju kao reduktivna bojila za bojenje proteinskih vlakana jer prelaze u leukospojeve već u slabo alkalnim otopinama, pa se ne oštećuju vlakna. Daju vrlo postojana obojenja.
Indigosoli ili leukoesteri reduktivnih bojila su soli estera sumporne kiseline s leukospojevima koji nastaju redukcijom karbonilnih skupina indigoidnih i antrakinonskih bojila. Karakterizira ih prisutnost grupacije Me03S0—C=C—C=C—OSO3Me (Me = kalij ili natrij). Vežu se iz neutralne kupelji na pamuk ili iz slabo kisele kupelji na vunu i svilu, a zatim se u drugoj kupelji, koja sadrži kiselinu, izvrši hidroliza estera i zbog prisutnosti oksidirajućih sredstava (natrijeva nitrita, natrijeva dikromata, feriklorida) istodobno oksidira hidroksilna grupa u karbonilnu. Njihove postojanosti odgovaraju postojanostima onih reduktivnih bojila od kojih se izvode. Upotrebljavaju se najčešće za bojanje pamuka, lana, regeneriranih celuloznih vlakana, a rjeđe za vunu i svilu. Odlikuju se izvanrednom sposobnošću egalizacije (izjednačivanja) i prodiranja u tkivo, pa se zato upotrebljavaju za pastelne nijanse, a vrlo se dobro primjenjuju i za bojanje komadne robe. Stanovitu upotrebu imaju i u bojanje kod štampanja (tisak).
Oksidacijska bojila ili oksidacijske baze su aromatski amino-, hidroksi-, diamino-, dihidroksi- ili aminohidroksi-spojevi koji tek nakon oksidacije na bojanom supstratu prelaze u bojila. Upotrebljavaju se za bojanje krzna, dlaka i perja. Struktura boja koje pri tom nastaju nije još u potpunosti razjašnjena. Najvjerojatnije je da iz amina i njihovih derivata nastaju azini, a iz aminofenola i njihovih derivata oksazini. Zbog složenih uslova koji vladaju pri bojanju (strukturno nejednoličan proteinski materijal supstrata, prisutnost različitih oksidacijskih sredstava, upotreba različitih metalnih močila, česta upotreba smjesa i kombinacija za bojanje) dolazi do niza paralelnih reakcija i nusreakcija što onemogućuje određivanje konstitucije nastale konačne boje. Primjeri su oksidacijskih baza: Ursol G, C.I. 76035 (m-toluilendiamin), Ursol D, C.I. 76060 (p-fenilendiamin), Ursol P, C.I. 76551 (hidroklorid p-aminofenola, Ursol ER, C.I. 76605 (a-naftol).
Ftalocijaninska bojila su derivati makrocikličkog sistema tetrabenzotetraazaporfina ili tetrabenzoporfirazina, koji je građen analogno osnovnom skeletu krvnih i lisnih boja (porfinu), a razlikuje se od njega po tome što su u njegovom unutarnjem, šesnaestočlanom prstenu metinska premoštenja zamijenjena dušikovim atomima. Većina tržišnih proizvoda ove grupe sadržava u molekuli složeno vezan atom nekog dvovalentnog metala (Cu, Co, Ni, Zn, Ca, Ba i tako dalje).
Na osnovnom sistemu mogu se nalaziti razne grupacije uvedene u molekulu općim metodama aromatske supstitucije, koje treba da omoguće topljivost u vodi, ili da povećaju kemijsku reaktivnost prema bojanom materijalu, ili da ishodnom bojilu promijene nijansu. Takve su grupacije — S03H, — S02NR2, — CH2X, — HX (X = halogen), Cl- i tako dalje. Ovako supstituirani ftalocijaninski spojevi mogu se također vezati na neke intermedijare (na primjer supstituirane salicilne kiseline) ili azo-kopulacijske komponente, pa se dobivaju bojila novih grupacija (močilna, naftol AS i tako dalje). Sva su bojila ove grupe izvanredno postojana, a bojaju materijal modro, tirkizno ili zeleno. Upotrebljavaju se za bojanje tekstilnih vlakana, papira, plastičnih masa, kao pigmentna bojila, kao bojila za građevna veziva i tako dalje. Nalazimo ih u različitim grupama bojila, kao na primjer među supstantivnim, močilnim, reduktivnim, sumpornim bojilima ili među bojilima koja se grade na vlaknu (naftolima AS). Najvažniji su primjeri ove grupe: Heliogenblau G, C.I. 74100, priprema se najčešće grijanjem dinitrila ftalne kiseline s Heliogenblau G alkoholima, fenolima ili amidima, ili odvajanjem metalnih atoma iz metalnih ftalocijanina pomoću jakih kiselina; Heliogenblau B, C.I. 74160, bakarna kompleksna sol prethodne boje, dobiva se grijanjem dinitrila ftalne kiseline s bakarnim kloridom na 180 do 200 ˚C. Sulfuriranjem ovog bojila oleumom na 50 do 60°C nastaje Siriuslichttiirkisblau GL (Heliogenblau SBL), C.I. 74180, a kloriranjem dolazi do ulaženja 15 ili 16 atoma klora u molekulu te se dobiva Heliogengriin G, C.I. 74260.
Ftalocijaninski razvijači (phthalogen-bojila) su organski intermedijari koji se posebnim postupcima vežu na supstrat istodobno s nekom metalnom soli, te naknadnom obradom grijanjem u prisutnosti reduktivnih sredstava prelaze na obojenom materijalu u nesupstituirane ili na određeni način supstituirane ftalocijanine. Takvi su intermedijari na primjer l-amino-3-iminoizoindolenin, Phthalogenbrillantblau IF3G, iz kojeg na vlaknu nastaje već spomenuti Heliogenblau B, C.I. 74160, i l-amino-3-imino-4 fenilizoindolenin, Phthalogenbrillantgriin IFFB.
Koriste se u prehrambenoj industriji, mikroskopiji, umjetnosti, pirotehnici, tekstilnoj industriji, građevinarstvu, itd.
Služe bojanju tijesta, šlaga, ljuski jaja, začina, i tako dalje, te su kao takva označena E-brojevima. Manji broj je u širokoj uporabi, a ostale boje dobivaju se njihovim miješanjem. Trenutno najpoznatija bojila u Sjedinjenim Američkim državama su:
- Jarko plava FCF, E 133 (plava)
- Indigotin, E 132 (tamno plava)
- Fast Green FCF, E143 (plavo-zelena)
- Allura Red AC, E129 (crvena)
- Erythrosine, E127 (ružičasta)
- Tartrazine, E102 (žuta)
- Sunset Yellow FCF, E110 (narančasta)
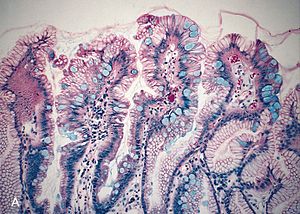
Koristi se prilikom bojanja mikroskopskih preparata sa svrhom poboljšavanja kontrasta struktura u preparatu prilikom mikroskopiranja. Također, koristi se i za mikroskopsku detekciju raznih tvari, pri čemu se bojilo veže za DNK, bjelančevine, masti, ugljikohidrate.
Koriste se zajedno s pigmentima za oslikavanje površina te bojanje dijelova od kojih se slažu primjerice dijelovi umjetničkih instalacija.
Koriste se uglavnom za pirotehničke smjese koje gorenjem daju obojani dim. Kao takve, najčešće guše reakciju gorenja.
Ovakva primjena je najraširenija i jedna od osnovnih i prvih u povijesti, te osnova tekstilne industrije.
Koriste se umiješane u inertni nosač i najčešće za bojanje zidnih površina.
- ↑ Kräutler, Bernhard. 26. veljače 2016. Breakdown of Chlorophyll in Higher Plants—Phyllobilins as Abundant, Yet Hardly Visible Signs of Ripening, Senescence, and Cell Death. Angew. Chem. Int. Ed. 4882 (55): 4882–4907. doi:10.1002/anie.201508928. PMC 4950323. PMID 26919572
- ↑ bojila. Hrvatska enciklopedija. Leksikografski zavod Miroslav Krleža
- ↑ "Tehnička enciklopedija" (Bojila), glavni urednik Hrvoje Požar, Grafički zavod Hrvatske, 1987.
- ↑ "Tehnička enciklopedija" (Prirodna bojila), glavni urednik Hrvoje Požar, Grafički zavod Hrvatske, 1987.
| Zajednički poslužitelj ima još gradiva o temi Bojilo |

